Télécharger le fichier pdf d’un mémoire de fin d’études
Le squelette conjonctif
Au niveau du corps caverneux
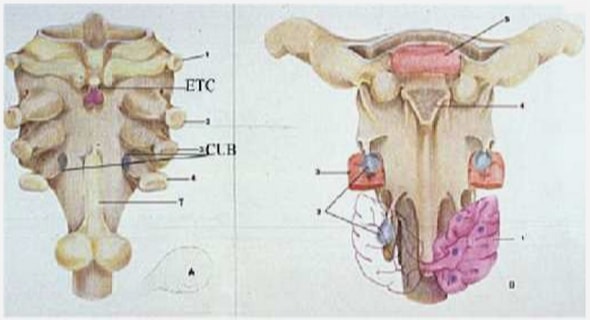
Le squelette conjonctif caverneux est constitué d’une enveloppe externe, l’albuginée, extrêmement solide qui est une membrane blanchâtre épaisse de 1 à 2 millimètres à l’état de flaccidité et 0.5 millimètre en érection. De sa face interne émanent de nombreuses cloisons fibreuses, les trabécules (figure 2) séparant le tissu caverneux en logettes contenant les aréoles (espaces sinusoïdes) et formant une véritable charpente à l’intérieur des corps caverneux. Il est riche en fibres collagènes et constitue 50% du volume des corps caverneux. Ce squelette joue un important rôle dans la limitation de la déformabilité pénienne pendant l’érection, dans la rigidification des corps caverneux et sert de support aux fibres musculaires lisses trabéculaires. [13,36]
Corps spongieux
A son niveau, l’albuginée est plus fine (0.2mm) et formée de fibres élastiques essentiellement. Ceci explique l’absence de verrouillage du flux veineux et ainsi l’absence de rigidification du corps spongieux au cours de l’érection (Figure 3) [13,36].
La composante musculaire lisse
Les fibres musculaires lisses occupent les espaces délimités par les trabécules avec les aréoles vasculaires érectiles et ont d’intimes connections entre elles, d’où leur fonctionnement synergique. Elles sont recouvertes d’un endothélium qui libère un neurotransmetteur responsable de leur relâchement au cours de l’érection. L’importance de leur rôle physiologique est soulignée par le fait qu’elles occupent environ 50% du volume caverneux. Ce pourcentage diminue progressivement avec l’âge et, semble-t-il, aussi dans certaines DE. Au niveau du corps spongieux elles sont vraiment moins abondantes [13,34].
Les aréoles vasculaires
Corps caverneux
Ce sont des structures virtuelles à l’état de flaccidité. Elles sont tapissées par une couche de cellules endothéliales et deviennent sphériques au cours de l’érection (figure 4). En dehors de ce rôle de réservoir sanguin reflété par les variations de volume lors de l’érection, elles ont aussi, un rôle de régulateur sur la contractilité des fibres musculaires lisses trabéculaires par le biais de sécrétions endothéliales [13,36].
Corps spongieux
A son niveau, les aréoles constituent 90% du volume et communiquent entre elles [36].
La vascularisation- innervation
Les artères
Les organes érectiles sont irrigués par des branches de l’artère honteuse interne, branche de l’artère iliaque interne. Dans 5 à 10% des cas, ces branches proviennent de l’artère honteuse interne accessoire qui vient soit de l’artère honteuse interne elle-même ou de l’artère obturatrice ou ischiatique. Elles constituent le système artériel profond de la verge, le système superficiel étant destiné aux enveloppes (figure 5).
Artères profondes du pénis (artères caverneuses) : elles parcourent totalement les corps caverneux donnant de nombreux rameaux en spirale : les artères hélicines.
Artère du bulbe du pénis : destinée à la partie postérieure du corps spongieux.
Artères urétrales : partie antérieure du corps spongieux et la partie pénienne de l’urètre
Artère dorsale du pénis : face dorsale du corps caverneux puis s’anastomose à la base du gland, d’où partent des rameaux pour le gland, le frein et le prépuce. [13, 34,59]
Les veines
Veines profondes : les veines drainant les corps érectiles se jettent dans la veine dorsale profonde du pénis qui monte entre les artères dorsales dans la gouttière supérieure des corps caverneux pour rejoindre le plexus veineux pré-vésical. Au cours de son trajet la veine dorsale profonde du pénis reçoit des rameaux supérieurs issus des corps caverneux et latéraux, issus du corps spongieux et entourant les corps caverneux [9] [59] (figure 6).
Les veines superficielles : elles drainent les enveloppes, se jettent dans la veine dorsale superficielle qui monte à la face dorsale du pénis et se termine à la racine de la verge, dans la veine grande saphène [9].
Les nerfs
L’innervation est double, somatique (motrice et sensitive) et végétative (sympathique et parasympathique), couronnée par une commande centrale.
L’innervation somatique
Elle est assurée par le nerf honteux interne, issus du plexus honteux qui réunit les branches antérieures des 3ème et 4ème nerfs sacrés et une partie de la branche antérieure du 2ème nerf sacré [13] [36].
Innervation efférente motrice
Les motoneurones du nerf honteux interne sont situés dans le noyau d’Onuf dans la corne antérieure de la substance grise de la moelle sacrée (S2, S3, S4). Ils assurent l’innervation efférente des muscles ischio caverneux et bulbo-spongieux qui en se contractant augmentent la pression intra-caverneuse lors de l’érection. Bien que le nerf honteux interne soit responsable de la super rigidité pendant l’érection, sa section n’abolit pas l’érection chez l’animal [57][1].
Innervation afférente sensitive
Il s’agit essentiellement des fibres sensitives afférentes du nerf dorsal du pénis qui rejoignent le nerf honteux interne (figure 8). Leurs terminaisons sont situées au niveau de la peau pénienne, du prépuce, de l’uretère et du gland (où elles sont plus importantes) [34,57]. Chez l’homme, l’atteinte du nerf dorsal de la verge entrainerait des troubles de l’érection [57].
Innervation végétative
Voie parasympathique (pro-érectile) : les neurones pré-ganglionnaires parasympathiques destinés au pénis sont issus du noyau parasympathique sacré situé dans la zone inter-médiolatérale de la substance grise de la moelle sacrée (S2, S3, S4). Les axones rejoignent le tissu érectile par les nerfs pelviens puis caverneux en passant par le plexus pelvien (figure 8) [57].
Voies sympathiques (anti-érectile) : elles sont issues de la moelle thoraco-lombaire (T11, T12, L1, L2) et empruntent deux (2) trajets principaux. Un contingent emprunte la chaine sympathique para vertébrale lombaire puis sacrée, rejoint le pénis par le nerf honteux. L’autre rejoint les ganglions sympathiques paravertébraux lombaires puis le plexus pelvien en passant par le nerf hypogastrique (figure 8) [36] [13]. Le nerf hypogastrique qui joue un rôle bien connu dans l’éjaculation, pourrait intervenir dans la commande des érections psychogènes et/ou représenter une voie de suppléance pro-érectile après la lésion du centre parasympathique sacré [36] [57].
L’érection et l’éjaculation nécessitent un parallélisme d’action entre le sympathique et le parasympathique. Le tonus alpha-adrénergique sympathique inhibiteur entraine la flaccidité en contractant l’éponge érectile. La levée de ce tonus et la mise en action du parasympathique déclenchent l’érection [34].
Interaction entre innervation somatique et végétative
Elle concerne surtout la voie parasympathique et la voie somatique qui agissent en synergie entrainant respectivement, la relaxation des fibres musculaires lisses et la contraction des fibres musculaires striées au cours de l’érection [36].
Contrôle supramédullaire
Il se fait au niveau bulbaire (noyau paragigantocellulaire), hypothalamique (noyau paraventriculaire et aire préoptique médiane), thalamique, limbique et cortical [13].
Déroulement de l’érection
La flaccidité est liée à la contraction des fibres musculaires lisses caverneuses qui ferme les espaces sinusoïdes sous l’action du tonus sympathique.
A l’occasion d’une stimulation, il y a levée du tonus sympathique, mise en route du système parasympathique résultant de la libération d’un neuromédiateur (le monoxyde d’azote) et le début de l’érection qui se passe en 3 phases :
La tumescence
Le monoxyde d’azote (NO) neuronal déclenche le relâchement des fibres musculaires lisses entrainant une baisse de la pression intra-caverneuse et l’ouverture des espaces sinusoïdes qui se remplissent de sang artériel. Cet afflux de sang entraine une augmentation de volume des corps caverneux qui met en tension des fibres élastiques de l’albuginé, comprime peu à peu le plexus veineux situé sous l’albuginée et une diminution croissante du retour veineux. Il s’agit d’un mécanisme veino-occlusif passif [59] [1].
La rigidité
Elle est obtenue grâce à la mise en tension des fibres élastiques et le blocage du retour veineux due à une augmentation de la pression intra-caverneuse. Le cœur sexuel, une entité anatomo-physiologique, associant les mécano et baro récepteurs du gland qui vont stimuler la contraction des muscles ischio et bulbo caverneux. Cela permet une augmentation supplémentaire de la pression intra caverneuse améliorant la rigidité et facilitant la pénétration. La compression au niveau de la racine des corps caverneux est néanmoins très faible permettant une sortie du sang équivalente au faible apport artériel créé par la pression intra-caverneuse [13] [1] [5].
Les cellules endothéliales qui tapissent la surface des aréoles (espaces sinusoïdes) sont étirées par le remplissage artériel sanguin et sécrètent du NO qui participe au maintien de l’érection [58].
La détumescence
Sous l’action du système sympathique, une remise en tension des fibres musculaires lisses des corps caverneux va réduire l’apport artériel et augmenter le retour veineux, souvent après l’éjaculation dont le contrôle neurologique est similaire [34].
La figure 10 montre les modifications vasculaires observées au cours de l’érection, l’augmentation des espaces caverneux et le blocage du retour veineux.
La figure 11 montre la compression du plexus veineux sous albuginéal due à la mise en tension des fibres élastiques de l’albuginée et le retour à l’état flaccide.
Commande neurologique locale de l’érection
Comme expliquée plus haut, l’érection se fait sous le contrôle pro-érectile parasympathique et anti-érectile sympathique à l’état de flaccidité.
Des études plus approfondies ont démontré l’existence de mécanismes plus complexes faisant intervenir des neuromédiateurs pendant les différentes phases de l’érection, principalement le monoxyde d’azote (NO) largué par les terminaisons nerveuses non adrénergiques non cholinergiques et par les cellules endothéliales des corps érectiles qui est myogénique intrinsèque, le tonus adrénergique et les facteurs vasoconstricteurs endothéliaux.
Mécanismes intracellulaires
Le tonus des fibres musculaires lisses des corps caverneux est étroitement lié à la concentration intracellulaire de calcium (Ca2+). Celle-ci est régulée par les nucléotides cycliques, guanosine 3′, 5′- phosphate (GMPc) et l’adénosine 3′, 5′-phosphate (AMPc), qui activent des mécanismes enzymatiques responsables d’une diminution du stock de calcium libre intracellulaire ayant pour conséquence la relaxation des fibres musculaires lisses caverneuses. Les nucléotides cycliques AMPc et GMPc, représentent les seconds messagers intracellulaires des neuromédiateurs et facteurs endothéliaux pro érectiles [114].
Le NO libéré par les terminaisons nerveuses non adrénergiques, non cholinergiques et les cellules endothéliales augmentent la concentration de GMPc dans les fibres musculaires lisses caverneuses (figure 12).
Le peptide intestinal vaso-actif (VIP) libéré par les terminaisons nerveuses et la prostaglandine E1 augmentent la concentration de l’AMPc dans les fibres musculaires lisses caverneuses. Il existe donc deux voies responsables de la relaxation des fibres musculaires lisses, la plus importante étant la voie NO-GMPc.
La décharge sympathique au moment de l’éjaculation associée à l’arrêt de la libération du NO, et à la dégradation de la GMPc et AMPc par les phosphodiestérases V et III, sont responsables de la détumescence pénienne après la phase d’érection [5] [114].
Mécanismes intercellulaires
Le changement de tonus coordonné et synchrone des cellules musculaires lisses lors de l’érection s’explique par un système de communication intercellulaire très développé assuré par des structures protéiques, les gap-junctions, qui unissent des fibres musculaires lisses voisines et permettent la transmission rapide des signaux électriques ou chimiques entre elles. Ces gap-junctions font du tissu érectile un syncytium fonctionnel [5]. Chaque fibre musculaire lisse n’a pas besoin d’être la cible directe d’un médiateur pour se relâcher ou se contracter en phase avec ses voisines.
Les flèches pleines représentent des mécanismes de sécrétion ou de stimulation, les flèches en pointillés représentent des mécanismes d’inhibition ou de dégradation enzymatique. O2 : oxygène, eNOS : NO synthase endothéliale, nNOS : NO synthase neuronale, NO : monoxyde d’azote, Ach : acétylcholine, GC : guanylate cyclase, GMPc : guanosine monophosphate cyclique, GTP : guanosine triphosphate, PKG : protéine kinase G, AC : adénylate cyclase, AMPc : adénosine monophosphate cyclique, ATP : adénosine triphosphate, PKA : protéine kinase A, PDE : phosphodiestérase, Gs : protéine G, PGE1 : prostaglandine E1 ; NE : norépinéphrine.
Les différents neuromédiateurs de l’érection
Neuromédiateurs pro-érectiles :
Le monoxyde d’azote (NO) :
Comme expliqué plus haut, le NO libéré lors d’une stimulation sexuelle augmente la concentration du GMPc dans les fibres musculaires lisses qui par des cascades biochimiques entraine une relaxation de ces fibres puis l’érection [72].
L’acétylcholine (ACH) :
Son rôle est de provoquer la libération de NO à partir des cellules endothéliales. L’ACH inhiberait également la libération de noradrénaline par les terminaisons nerveuses sympathiques [29].
Le peptide intestinal vaso -actif (VIP) :
Le VIP n’est pas reconnu comme un médiateur déterminant de l’érection. Néanmoins ses effets myorelaxants sur les corps caverneux permettent d’expliquer son rôle facilitateur de l’érection lors de son administration intra caverneuse chez l’homme. Le VIP agit en augmentant la concentration intracellulaire en AMPc [34] [120].
Les neuromédiateurs anti-érectiles
La noradrénaline (NA) :
Elle est le neuromédiateur classique du système sympathique post ganglionnaire. La présence de récepteurs alpha adrénergiques et leur rôle dans la contraction des corps caverneux chez l’homme a été démontré. Les récepteurs adrénergiques post sympathiques de type alpha 1 seraient prédominants sur les fibres musculaires lisses du tissu érectile, alors que les récepteurs adrénergiques de type alpha 2 seraient plus nombreux sur les fibres musculaires lisses artérielles. Ces données expliquent l’efficacité des drogues alpha stimulantes dans le traitement des érections pharmacologiquement prolongées et des priapismes vus précocement [34].
Le neuropeptideY (NPY)
C’est un neuromédiateur peptidergique qui est colocalisé avec la noradrénaline dans les terminaisons nerveuses sympathiques dans l’ensemble de l’organisme [120] [59].
L’endothéline
L’endothéline (ET), également synthétisée et libérée par l’endothélium, est le plus puissant peptide vasoconstricteur connu [28]. In vitro l’endothéline 1 contracte les fibres musculaires lisses caverneuses et agit en synergie avec la noradrénaline.
Rôle de l’oxygène
Lors de la flaccidité, la synthèse de NO est inhibée en raison du faible taux de la pression partielle en oxygène (Po2) du sang aréolaire, similaire à la Po2 veineuse. Ce faible taux de NO facilite le maintien de la flaccidité par suppression des mécanismes myorelaxants NO dépendant et facilitation du tonus constricteur. A l’inverse, lors de l’érection, la P02 augmente (100 mmHg environ), fournissant suffisamment d’02 pour la synthèse de NO [34]. D’après les études in vitro la concentration caverneuse minimale en 02 nécessaire à une pleine activité de la NO synthétase se situe entre 50 et 60 mmHg. Des concentrations inférieures induiraient une sécrétion partielle de NO responsable d’une relaxation partielle du muscle trabéculaire. La synthèse de l’endothéline est également modulée par la concentration en 02. Une Po2 basse favorise sa synthèse, tandis qu’une P02 haute l’inhibe. Cette capacité de la molécule d’02 à réguler la synthèse de substances endogènes vaso-actives lui confère un rôle modulateur important de l’activité érectile du pénis [16]. Dès lors on comprend aisément le rôle négatif de l’athérosclérose et de l’hypoxie qui l’accompagne sur l’obtention et le maintien d’une érection de qualité.
Ainsi la pharmacologie périphérique de l’érection est désormais mieux connue. Cependant elle reste complexe et de nombreuses conditions pathologiques peuvent altérer ces mécanismes périphériques régulant le tonus du tissu érectile notamment :
l’athérosclérose : En effet, l’origine embryologique commune entre le système vasculaire et le système érectile, font que les corps érectiles ne sont que des « vaisseaux » hyperspécialisés présentant des mécanismes physiopathologiques communs dominés par l’athérosclérose, la dysfonction endothéliale et l’ischémie chronique qu’elle entraîne toutes responsables d’une baisse du NO.
Le vieillissement, par l’hypersensibilité des fibres musculaires lisses à la noradrénaline
le diabète dans le cadre de la microangiopathie diabétique avec altération fonctionnelle des terminaisons nerveuses végétatives et des cellules endothéliales,
les dénervations périphériques après chirurgie carcinologique ou radiothérapie pelvienne,
Le stress, par augmentation de la libération de catécholamines.
La DE apparaît donc comme un véritable marqueur clinique de l’état de santé globale (sexuel, physique et psychique) et de la qualité de vie. Il peut être comparé à une fenêtre qui s’ouvrirait sur des pathologies chroniques très diverses comme l’athérosclérose, le diabète et la dépression. Ce concept de DE symptôme met en avant l’intérêt d’une bonne investigation étiologique car pouvant être révélateur de maladie cardio-vasculaire.
ETIOPATHOGENIE DE LA DYSFONCTION ERECTILE
L’érection résulte d’un double mécanisme : central, psycho-neuro-endocrinien, intégrant le désir et les stimuli sexuels et locaux, neuro-vasculaire permettant le maintien du phénomène jusqu’à l’éjaculation et l’orgasme [36]. Comme décrit plus haut, le cycle érectile comporte 3 phases : la tumescence, la rigidité et la détumescence. Ainsi l’altération d’un ou plusieurs des mécanismes ou éléments intervenant dans ce cycle va entrainer une DE. Cela nous permet donc de regrouper les mécanismes physiopathologiques en 3 groupes :
– Le non déclenchement de l’érection qui résulte d’une atteinte centrale, psychogène ou endocrinienne, de la non transmission du message sexuel (impuissance neurologique) ou d’une absence de levée du tonus adrénergique (DE fonctionnelle autrefois appelée psychogène)
– L’insuffisance d’apport qui est le plus souvent liée à une insuffisance artérielle dont la forme la plus typique est le syndrome de LERICHE qui est une oblitération athéromateuse de la bifurcation aortique associant souvent des troubles érectiles, une claudication intermittente, hypopulsatilité fémorale.
– L’insuffisance de maintien qui résulte de la détérioration des mécanismes veineux, musculaires, tissulaires ou neurologiques maintenant le sang dans la verge pendant l’érection.
La dysfonction érectile est souvent multifactorielle et elle induit toujours une anxiété de performance chez le patient qui aggrave les troubles initiaux.
Nous retrouvons donc deux groupes étiologiques : les DE d’origine psychogène et les DE organiques.
|
Table des matières
INTRODUCTION
PREMIERE PARTIE : REVUE DE LA LITTERATURE
CHAPITRE I : RAPPEL SUR L’ERECTION
I. ANATOMIE DES ORGANES ERECTILES
I.1 Configuration externe
I.1.1. Corps caverneux
I.1.2. Corps spongieux
I.2. Structure
I.2.1. Le squelette conjonctif
I.2.2. La composante musculaire lisse
I.2.3. Les aréoles vasculaires
I.2.4. La vascularisation- innervation
I.2.5. Les muscles striés
I.2.6. Les nerfs
II. PHYSIOLOGIE DE L’ERECTION
II.1. Déroulement de l’érection
II.1.1. La tumescence
II.1.2. La rigidité
II.1.3. La détumescence
II.2. Commande neurologique locale de l’érection
II.2.1. Mécanismes intracellulaires
II.2.3. Les différents neuromédiateurs de l’érection
CHAPITRE II : ETIOPATHOGENIE DE LA DYSFONCTION ERECTILE
I. LA DYSFONCTION ERECTILE D’ORIGINE PSYCHOGENE
II. LA DYSFONCTION ERECTILE D’ORIGINE ORGANIQUE
II.1. Causes cardio-vasculaires
II.2. Causes neurologiques
II.3. Causes endocrinologiques
II.4. Causes urologiques
II.5. Causes iatrogènes
II.6. Causes toxiques
II.7. L’âge [107] [99]
CHAPITRE III : RELATION ENTRE DYSFONCTION ERECTILE ET PATHOLOGIES CARDIO-VASCULAIRES
I. EPIDEMIOLOGIE
II. DYSFONCTION ERECTILE ET MALADIES CARDIOVASCULAIRES
CHAPITRE IV : DIAGNOSTIC
I. DIAGNOSTIC POSITIF
I.1. Circonstances de découverte
I.2. Examen clinique
I.2.1. Interrogatoire
I.2.2. Examen physique
I.3. Examen paraclinique
I.3.1. Examen de première intention
CHAPITRE V : PRISE EN CHARGE THERAPEUTIQUE
I. LA PRISE EN CHARGE PSYCHO-SEXOLOGIQUE
II. MODIFICATION DES FACTEURS REVERSIBLES
II.1. Hygiène de vie
II.2. Traitement des comorbidités
III. Les traitements spécifiques
III.1. Traitements oraux
III.1.1. Inhibiteurs de la phosphodiestérase de type 5 (IPDE-5)
III.1.2. Yohimbine
III.1.3. Apomorphine
III.2. Les traitements locaux
III.2.1. Injections intra-caverneuses (IIC)
III.2.2. Bâton à usage intra-urétral (Muse®)
III.2.3. Le vacuum
III.3. Traitement chirurgical
III.3.1. Chirurgie vasculaire
III.3.2. Prothèses ou implants péniens
DEUXIEME PARTIE : NOTRE ETUDE
I. OBJECTIFS DE L’ETUDE
I.1. Objectif général
I.2. Objectifs spécifiques
II. CADRE D’ETUDE
II.1. Le secteur des explorations fonctionnelles
II.3. La salle d’angiographie et de rythmologie interventionnelle
II.4. Le fonctionnement du service
III. Méthodologie
III.1. Type et période d’étude
III.2. Population d’étude
III.2.1. Critères d’inclusion
III.2.2. Critères de non inclusion
III.3. Déroulement de l’étude
III.3.1. Paramètres étudiés
III.3.2. Définition des variables
III.4. Recueil de données et analyse statistique
RESULTATS
I. Données socio-démographiques
I.1. Effectif
I.2. L’âge
I.3. Situation et régime matrimoniaux
I.4. Niveau d’étude
I.5. Activité professionnelle
I.6. Niveau socio-économique
II. Sévérité de la dysfonction érectile (DE)
III. L’ECG
IV. Mode de vie et facteurs de risque cardio-vasculaire
IV.1. Mode de vie
IV.2.1. Hypertension artérielle
IV.2.2. Tabagisme
IV.2.3. Diabète
IV.2.4. Dyslipidémie
IV.2.5. Obésité
IV.3. Nombre de facteurs de risque cardio-vasculaire
IV.4. Score de Framingham
V. Fréquence cardiaque
VI. Echographie cardiaque
VII. Facteurs de risque cardiovasculaire et sévérité de la DE
DISCUSSION
I. Discussion sur la méthodologie
II. Discussion proprement dite
II.1. Caractéristiques socio-démographiques
II.2. Degré de sévérité
II.3. Facteurs de risque cardio-vasculaire
II.3.1. Hypertension artérielle
II.3.2. Diabète
II.3.3. Dyslipidémie
II.3.4. Tabagisme- alcoolisme
II.3.5. Obésité
II.3.6. Sédentarité
II.3.7. La présence de plusieurs facteurs de risques
II.5. Score de Framingham
II.6. Facteurs de risque cardio-vasculaire et sévérité de la dysfonction érectile
CONCLUSION
REFERENCES BIBLIOGRAPHIQUES
ANNEXE
Télécharger le rapport complet