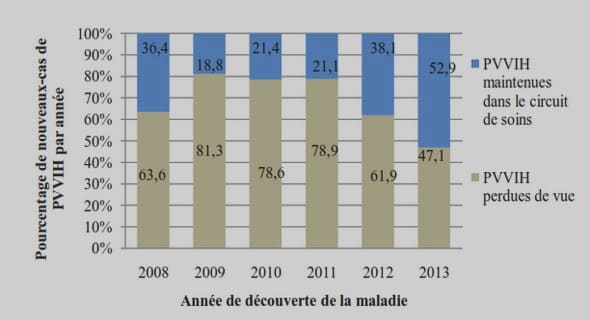
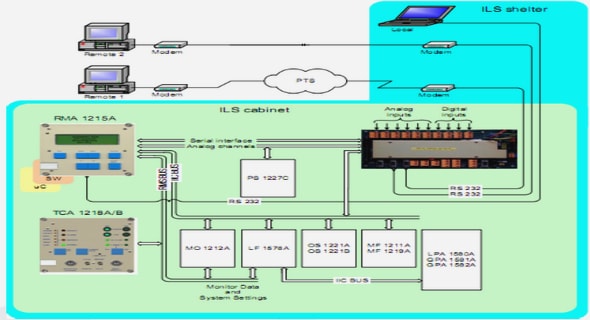
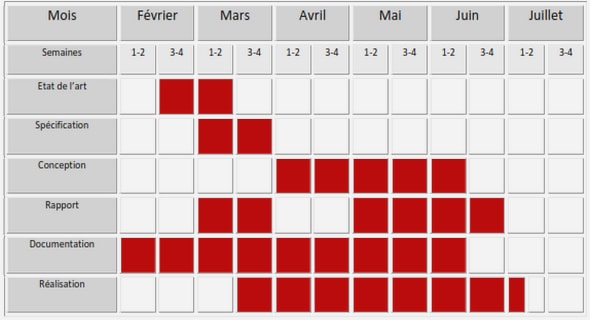
Télécharger le fichier pdf d’un mémoire de fin d’études
Interaction stéréospécifique entre sélecteurs et énantiomères
Complexe diastéréoisomérique et énantiosélectivité
|
Table des matières
INTRODUCTION
CHAPITRE I : PHASES STATIONNAIRES CHIRALES POUR L’ELECTROCHROMATOGRAPHIE CAPILLAIRE
Chiralité : Généralités
Reconnaissance chirale et énantiosélectivité par voie électrocinétique
II.1. Règle des trois points d’attache (Easson et Stedman)
II.2. Interaction stéréospécifique entre sélecteurs et énantiomères
II.3. Complexe diastéréoisomérique et énantiosélectivité
Sélecteurs chiraux en CEC
III.1. Sélecteurs sur mesures
III.1.1. Les polymères à empreintes moléculaires (MIPs)
III.1.2. Les aptamères
III.1.3. Les glycopeptides macrocycliques (ou antibiotiques)
III.2. Sélecteurs conventionnels
III.2.1. Les protéines
III.2.2. Les alcaloïdes naturels à base de quinquina
III.2.3. Les échangeurs de ligands
III.2.4. Le sélecteur Whelk-O-1 ou Pirkle
III.2.5. Les éthers couronnes
III.2.6. Les polymères synthétiques
III.2.7. Les polysaccharides
III.2.8. La cyclodextrine (CD)
Electrochromatographie capillaire
IV.1. Principe de la CEC
IV.2. Flux électroosmotique, mobilité électrophorétique et paramètres électrochromatographiques
Electrochromatographie capillaire chirale en tube ouvert
V.1. CSPs par adsorption de multicouches de polyélectrolyte (PEM)
V.2. CSPs non poreuses greffées de façon covalente
V.3. CSPs poreuse en Tube Ouvert
V.4. MIPs chiraux
V.5. CSPs sur colonnes gravées
V.6. CSPs sur colonnes en OT-CEC avec des nanoparticules
Electrochromatographie capillaire chirale sur monolithe
VI.1. Phase stationnaire monolithique sous forme de gel de polyacrylamide
VI.1.1. Synthèse directe de CSPs monolithes gels organiques de type poly(méth)acrylamide
VI.1.2. Synthèse indirecte de CSPs monolithes gels organiques de type poly(méth)acrylamide
VI.2. Phase stationnaire monolithique polymère (méth)-acrylate
VI.2.1. Synthèse directe de CSPs monolithes organiques rigides
VI.2.2. Synthèse indirecte de CSPs monolithes organiques rigides
VI.3. Phase stationnaire monolithique inorganique et hybride à base de sol-gel
VI.3.1. Synthèse directe de CSPs monolithes sol-gel inorganiques
VI.3.2. Synthèse indirecte de CSPs monolithes sol-gel inorganiques
Conclusion
Annexe
CHAPI TRE II : PHASES STATIONNAIRES COVALENTES A BASE DE CARBOXYMETHYL CYCLODEXTRINE POUR L’ELECTROCHROMATOGRAPHIE CAPILLAIRE EN TUBES OUVERTS (OT-CEC)
Introduction
I.1. Problématique de la séparation chirale en électrophorèse
I.2. Définition de la stratégie de greffage pour l’énantioséparation en CEC
Gravure chimique de la silice du capillaire par le procédé « etching »
II.1. Principe
II.2. Mise en œuvre de la gravure par le sel de bifluorure d’ammonium
II.3. Caractérisation de la surface du capillaire gravé par microscopie à force atomique (AFM) et microscopie électronique à balayage (MEB)
II.4. Caractérisation de la gravure par une étude de flux électroosmotique Modification du capillaire par l’APTEOS en milieu organique
III.1. Principe
III.2. Mise en œuvre de la silanisation
III.3. Caractérisation de l’état de surface après silanisation par voie électrocinétique Greffage du sélecteur de cyclodextrine en surface de la silice modifiée
IV.1. Principe
IV.2. Mécanismes
IV.3. Caractérisation du greffage du p-CDen CEC avec et sans agents de couplages EDC/NHS
IV.4. Effet de la gravure sur la CSP à base de p-CDen OT-CEC
Effet des variations des conditions opératoires sur les propriétés énantioséparatives de la phase stationnaire covalente à base de p-CD-
V.1. Effet de la tension de séparation sur des CSPs en colonnes gravées et non gravées
V.2. Effet de la température sur la séparation sur des CSP en tubes gravés
V.3. Effet de la nature du tampon sur la séparation sur des CSPs en colonnes gravées
V.4. Effet de la longueur de la colonne sur la qualité de la séparation
V.5. Effet de la nature du selecteur greffé
V.6. Effet du couplage du p-CDen milieu organique avec TBTU/TEA
Conclusion
CHAPITRE III : PHASES STATIONNAIRES MONOLITHIQUES A BASE DE -CYCLODEXTRINE POUR L’ELECTROCHROMATOGRAPHIE CAPILLAIRE CHIRALE
Introduction
I.1. Définition de la stratégie d’élaboration des CSPs sur support monolithique
I.2. Description des supports monolithiques employés pour la synthèse de CSP
Synthèse de CSP sur monolithe organique « 6a36 »
II.1. Principe
II.2. Mise en œuvre des CSPs à partir du support « 6a36 »
II.3. Caractérisation de la matrice « 6a36 » par MEB, spectroscopie RAMAN et CEC
II.4. Caractérisation de la fonctionnalisation de la matrice « 6a36 »
II.4.1. Caractérisation en RAMAN et CEC des CSPs obtenues avec la stratégie de greffage covalent
II.4.2. Caractérisation en RAMAN et CEC des CSPs obtenues avec la stratégie d’immobilisation non covalente136
II.5. Caractérisation des différentes CSPs élaborées en CEC chirale
Synthèse de CSP sur monolithe EGMP-BA par voie non covalente
III.1. Principe
III.2. Mise en œuvre
III.3. Caractérisation de la CSP par MEB et mesures de FEO en CEC
III.4. Séparation chirale en m-CEC sur la matrice EGMP-co-BAA modifiée par le p-CD+
Synthèse de CSP sur SPMA-MPTS-TEOS par voie non covalente
IV.1. Principe
IV.2. Mise en œuvre
IV.3. Caractérisation du support monolithe par MEB et CEC
IV.4. Séparations chirales en m-CEC sur la matrice SPMA-MPTS-TEOS modifiée par le p-CD+
Conclusion
CONCLUSION GENERALE ET PERSPECTIVES
PARTIE EXPERIMENTALE
Appareillages
I.1. Electrophorèse capillaire et Nanobaume
I.2. Analyses en Spectroscopie Raman
I.3. Analyses en Microscopie Electronique à Balayage
I.4. Analyses en Microscopie à Force Atomique
I.5. Autres appareillages
Réactifs et solutés
II.1. Liste des sélecteurs chiraux employés en OT-CEC
II.2. Liste des réactifs employés en OT-CEC
II.3. Liste des sélecteurs chiraux employés en m-CEC
II.4. Liste des réactifs employés en m-CEC
II.4.1. Réactifs pour les CSPs sur NAS-co-EDMA
II.4.2. Réactifs pour les CSPs sur EGMP-BAA
II.4.3. Réactifs pour les CSPs sur SPMA-MPTS-TEOS
II.5. Liste des solvants utilisés
Préparation des électrolytes tampons
Elaboration de CSPs sur colonnes gravées pour l’OT-CEC
IV.1. Gravure des tubes ouverts par NH4, HF2 saturé dans le MeOH
IV.2. Greffage de l’APTEOS en surface de la silice dans le toluène
IV.3. Couplage des sélecteurs chiraux en milieu aqueux avec EDC/NHS
IV.3.1. Couplage peptidique du polymère p-CD-
IV.3.2. Couplage peptidique des monomères CM-β-CDet Scc-β-CD-
IV.4. Couplage des sélecteurs chiraux en milieux non aqueux avec TBTU/TEA
Elaboration des CSPs sur colonne monolithe pour la m-CEC
V.1. Mise en œuvre d’une CSP sur le monolithe SPMA-MPTS-TEOS
V.2. Mise en œuvre d’une CSP sur le monolithe EGMP-co-BAA
V.2.1. Activation du capillaire par le γ-MAPS
V.2.2. Elaboration des colonnes monolithes EGMP-co-BAA et leur fonctionnalisation
V.3. Mise en œuvre des CSPs sur le monolithe NAS-co-EDMA
V.3.1. Elaboration des supports monolithes NAS-co-EDMA en capillaire
V.3.2. CSPs obtenues avec la stratégie de greffage covalent
V.3.2.1. Mise en œuvre de la CSP1
V.3.2.2. Mise en œuvre de la CSP2
V.3.2.3. Mise en œuvre de la CSP3
V.3.2.4. Mise en œuvre de la CSP4
V.3.3. CSPs obtenues avec la stratégie d’immobilisation électrostatique
V.3.3.1. Mise en œuvre de la CSP5
V.3.3.2. Mise en œuvre de la CSP6
V.3.3.3. Mise en œuvre de la CSP7
Annexes
VI.1. Description de la CEC
VI.2. Tableaux solutés (nom, formule et pKa)
VI.3. Colonnes et solutés analysés en OT-CEC
VI.3.1. Liste des solutés racémiques injectés en OT-CEC (Couplage EDC/NHS)
VI.3.2. Liste des solutés racémiques injectés en OT-CEC (Couplage TBTU/TEA)
VI.4. Colonnes et solutés analysés en m-CEC
VI.4.1. Liste des solutés racémiques injectés dans les colonnes 6A36-EDA greffées avec le polymère p-CDvia EDC/NHS sur 10cm
VI.4.2. Liste des solutés racémiques injectés dans la colonne 6A36-EDA greffée par le monomère CMβ-CD- (0,5g.L-1) via EDC/NHS sur 10 cm
VI.4.3. Liste des solutés racémiques injectés dans les colonnes 6A36-EDA greffées par le monomère Scc-β-CD- (1g.L) via EDC/NHS sur 10 cm couplage à pH=8,0 Tris durant 15 minutes de réactions
VI.4.4. Liste des solutés racémiques injectés dans les colonnes 6A36- pCD+ non covalent
VI.4.5. Liste des solutés racémiques injectés dans les colonnes (EGMP-BAA)-p-CD+
VI.4.6. Liste des solutés racémiques injectés dans les colonnes (SPMA-MPTS-TEOS)-p-CD+
BIBLIOGRAPHIE
Télécharger le rapport complet