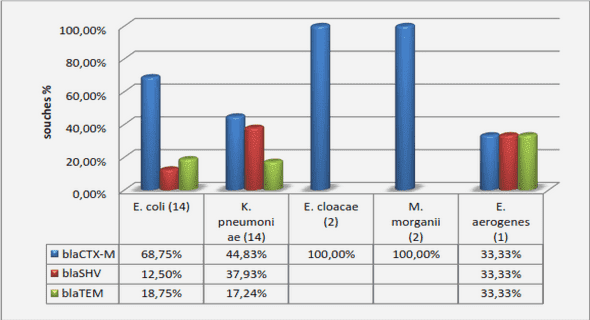
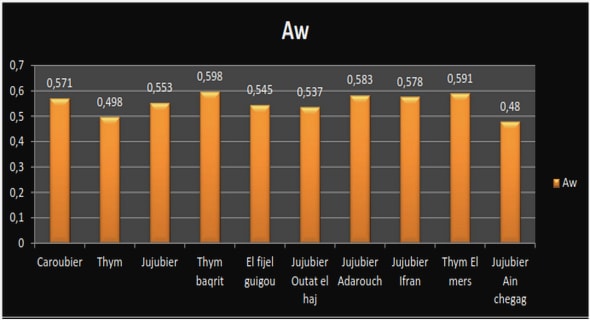
PRESENTATION DE LA STRUCTURE D’ACCUEIL
Historique
Depuis 1995, le MESSRS œuvre pour la mise en place du Plan Stratégique de la Recherche Scientifique (PSRS) par la mobilisation des ressources humaines et financières l’élargissement du partenariat, la mise en place de mécanismes de concertation avec les acteurs du développement, la mise en place d’un système national de recherche scientifique avec une implication des universités dans la mise en œuvre du Plan stratégique .
L’Institut de Recherche en Science de la Santé (lRSS) a été créé par arrêté ministériel en vertu du Décret N°961111/PRES/PM/MESSRS du 25/0411996 portant organisation du Ministère de l’Enseignement Secondaire Supérieur et de la Recherche Scientifique (MESSRS); afin remplacer l’ancien Institut de Recherche des Substances Naturelles (lRSN). Il constitue de nos jours l’un des quatre instituts du Centre National de Recherche Scientifique et Technologique (CNRST).
Le premier Directeur de Recherche de l’IRSS fût feu le Professeur Hilaire TIENDREBEOGO en 1996. Le Directeur de l’institut, depuis 1997, est le Pr Sylvain OUEDRAOGO. Le Pr Jean – Bosco OUEDRAOGO a dirigé la direction régionale de l’Ouest de 1997 à 2015, par ailleurs il a été le premier directeur régional de la recherche scientifique et de l’innovation technologique. L’actuel directeur régional est le Pr Rock K. DABIRE.
Présentation de l’IRSS
L’IRSS est l’institut du CNRST en charge de la recherche en science de la santé. Le champ d’action de l’institut couvre les domaines de la santé à travers les volets: santé publique, l’épidémiologie, la nutrition, la parasitologie, la virologie, la pharmacopée traditionnelles,la toxicologie.
Il est constitué d’une équipe pluridisciplinaire, qui a pour mission de mener des recherches qui puissent apporter des solutions aux problèmes prioritaires de santé et de coordonner la recherche dans le secteur de la santé au Burkina Faso. L’IRSS fonctionne à travers des programmes avec des thématiques bien définis. Ces thématiques concernent:
﹣le Paludisme et les Maladies Tropicales Négligées,
﹣les politiques et systèmes de santé,
﹣la santé de la mère et de l’enfant,
﹣la nutrition,
﹣la pharmacopée traditionnelle et les plantes médicinales,
﹣la toxicologie.
Organisation de l’IRSS
L’IRSS est sous la tutelle d’un Directeur, nommé en Conseil des Ministres sur proposition du Délégué Général du CNRST. Le département scientifique de l’IRSS est structuré en deux départements :
﹣le département Biomédical et de Santé publique (BIüMED/SP) chargé de développer la recherche dans le domaine de la bioc1inique, de la nutrition, de l’épidémiologie, des politiques et systèmes de santé.
﹣le département de Médecine, Pharmacopée Traditionnelles et de Pharmacie (MEPHATRA/P) chargé du développement de la recherche en médecine et pharmacopée traditionnelles et en pharmacie.
Mission de l’IRSS
Dès sa création, l’IRSS s’est donné la mission d’accompagner les acteurs de la santé par la recherche développement. Et pour cela, il s’est appuyé sur le diagnostic de l’état sanitaire du pays, des documents du Plan Stratégique de la Recherche en son volet Sciences de la Santé et de la Recherche Nationale Essentielle en Santé (RNES) pour spécifier les thèmes de recherche en santé .
Dans le cadre de ce champ d’action, les objectifs généraux de l’IRSS, basés sur la Recherche-Développement définis dans son statut sont les suivants:
﹣apporter des solutions aux problèmes prioritaires de santé;
﹣améliorer l’organisation et la gestion des systèmes de santé;
﹣contribuer à l’hygiène de l’environnement;
﹣contribuer à l’utilisation rationnelle des médicaments;
﹣valoriser la pharmacopée et la médecine traditionnelles;
﹣contribuer à la formation et à la recherche en santé;
﹣participer à la diffusion de l’information scientifique et technique en matière de
santé
﹣coordonner les recherches en santé.
PRESENTATION DU SUJET ET REVUE BIBLIOGRAPHIQUE
La pharmacovigilance
Historique
Les premiers médecins de l’Antiquité prescrivaient des drogues (digitale, opIUm, strychnine…) et en surveillaient la tolérance selon l’une des règles d’Hippocrate : «primum non nocere » (d’abord ne pas nuire). La pharmacovigilance mondiale n’a qu’un demi-siècle, et s’est esquissée entre 1850 et 1960. C’est en 1961, que le drame de la thalidomide, hypno-sédatif destinée aux femmes enceintes provoqua une véritable prise de conscience sur le problème, car tous les éléments propres à sensibiliser l’opinion étaient réunis: accidents imprévus, dramatiques, provoqués par un médicament jugé jusqu’alors anodin et utilisé selon les normes.
Au Burkina Faso, c’est en 1997 qu’un séminaire a été organisé par le centre de documentation et d’information sur le médicament (CEDIM) de la direction des services pharmaceutiques (DSPh), afin d’intéresser les prescripteurs et les dispensateurs sur le sujet. Par la suite, plusieurs professionnels de la santé ont participé depuis 2005 au cours international de pharmacovigilance organisé par le Centre de pharmacovigilance du Maroc. Avec l’appui du fond mondial et du programme de lutte contre le paludisme, des formations sur la pharmacovigilance ont été réalisées entre 2008 et 20 Il dans plusieurs districts sanitaires au profit des professionnels de santé. En Novembre 20 Il, le décret portant création et organisation d’un système national de vigilances des produits de santé a été adopté en conseil de ministres. Les arrêtés ministériels d’application sont en cours d’adoption. Le bilan des notifications spontanées de 2008 à décembre 2011 indique un total cumulé de 120 notifications dont 80 pour la seule année 2011 (manuel de formation en pharmacovigilance, 2012).
Eléments de définitions
La pharmacovigilance
L’expression pharmacovigilance a connu une évolution dans le temps. En 1969, l’OMS avait défini la phannacovigilance comme : « la notification, l’enregistrement et l’évaluation systématique des réactions adverses aux médicaments délivrés avec ou sans ordonnance ». En 1972, elle a été définie par l’OMS comme: « toute activité tendant à obtenir des indications systématiques sur les liens de causalité probables entre médicaments et réactions adverses dans une population ». Bégaud, quant à lui définie la pharmacovigilance comme : « la branche de la pharmacologie consacrée à l’étude et à la prévention des effets indésirables des médicaments ». Ce qui selon l’auteur, englobera non seulement l’approche clinique, épidémiologique et statistique mais aussi l’approche expérimentale et dépasse la simple analyse du lien de causalité pour s’intéresser aux facteurs de risque, aux mécanismes de survenue des effets indésirables et à leur prévention. La pharmacovigilance est définie comme étant la science et les activités se rapportant à la détection, à l’évaluation, à la compréhension et à la prévention des effets indésirables des médicaments ou de tout autre problème lié aux médicaments (OMS).
Quelques termes médicaux
La littérature propose plusieurs définitions de l’effet indésirable. Retenons celle de l’OMS:
➤ L’effet indésirable est tout effet nocif, non intentionnel qui survient aux doses de médicaments employées habituellement chez l’homme en vue de la prévention, du diagnostic ou du traitement. Selon le degré de gravité, les effets indésirables sont dits graves, sérieux, ou modérés:
﹣La réaction est grave si elle entraîne la mort, l’hospitalisation du patient, une infirmité ou une incapacité ou d’une quelconque manière met la vie en danger.
﹣La réaction sérieuse ou sévère nécessite des soins autres que le simple arrêt du médicament.
﹣La réaction modérée ou banale n’est ni grave ni sérieuse.
➤ L’effet indésirable inattendu est un effet indésirable non mentionné dans son type, sa gravité ou sa fréquence dans le résumé des caractéristiques du produit.
➤ L’événement indésirable est toute manifestation indésirable survenant chez une personne pendant un traitement, qu’elle soit considérée ou non, comme liée à des médicaments.
|
Table des matières
INTRODUCTION
I. PRESENTATION DE LA STRUCTURE D’ACCUEIL
1.1. Historique
1.2. Présentation de l’IRSS
1.3. Organisation de l’IRSS
1.4. Mission de l’IRSS
II. PRESENTATION DU SUJET ET REVUE BIBLIOGRAPHIQUE
2.1. La pharmacovigilance
2.1.1 Historique
2.1.2 Eléments de définitions
2.1.3 Intérêt de la pharmacovigilance
2.2. Le paludisme (Malaria)
2.2.1. Historique
2.2.2. Epidémiologie
2.3. Contexte générale de l’étude
2.3.1. Définition des effets indésirables
2.3.2. Reconnaissance d’un effet indésirable
2.3.3. Justification de l’étude
2.3.4. Objectif
III. MATERIELS ET METHODES
3.1. Matériels
3.1.1. Site de l’étude
3.1.2. Population cible
3.1.3. Critère d’inclusion
3.104. Critère de non inclusion (exclusion)
3.1.5. Critères pouvant entrainer l’arrêt temporaire du traitement ou le retrait du patient de l’étude
3.1.6. Traitement concomitant
3.1.7. Les médicaments de l’étude
3.1.8. Les logiciels utilisés
3.2. Méthodes
3.1.1. Plan d’échantillonnage
3.1.2. Méthode d’analyse statistique
4. RESLTLTATS
4.1. Résultats
4.1.1. Profil des patients
4.1.2. Proportion des évènements indésirables
4.1.3. Tabulation de différentes variables par rapport aux évènements indésirables
4.1.4. Délais de survenu et risque relatif (RR) d’un évènement indésirable
5. Discussion
5.1. Discussion sur le résultat
5.2. Discussion sur la validité des méthodes utilisées
CONCLUSION
ANNEXES
Bibliographie
![]() Télécharger le rapport complet
Télécharger le rapport complet