Les progrès scientifiques et technologiques réalisés ces dernières années, notamment en matière de micro-technologies et d’imagerie [Dunc00], permettent aujourd’hui d’appliquer des traitements peu invasifs, voire mini-invasifs, faisant appel à différents principes d’interaction avec les tissus (mécaniques, électromagnétiques, biochimiques, …) au moyen d’outils (flexibles, rigides) et/ou d’agents pharmacologiques introduits par voies intracorporelles. De ces traitements naissent de nouvelles exigences en terme d’apprentissage, de réalisation du geste (manoeuvrabilité réduite et à distance, suivi visuel intensif, retour tactile réduit) et d’ergonomie. L’accroissement de la dextérité du praticien exigé par ces nouvelles techniques interventionnelles atteint sa limite et ne suffit plus à répondre aux critères imposés par le contexte institutionnel (sécurisation, fiabilisation et traçabilité du geste), voire dans certains cas, à assurer la faisabilité de la procédure. L’enjeu sur le plan clinique réside dans l’exploitation des observations peropératoires et leur confrontation aux informations du planning. Avec le développement de nouvelles techniques d’observation multi-modalités et multiéchelles on pourrait envisager à terme une découverte des lésions à un stade de plus en plus précoce pour lesquelles de nouvelles approches thérapeutiques seront à définir [Heng01].
Sur la base d’observations réalisées à l’échelle macroscopique, le planning et le guidage d’interventions par ordinateur se sont principalement concrétisés ces dernières années au travers d’applications cliniques telles que l’orthopédie (structures osseuses) ou la neurochirurgie (organe encapsulé dans des structures osseuses) [Shah01]. Ils sont désormais appelés à concerner l’ensemble des spécialités, l’un des enjeux pour l’avenir se situant au niveau des tissus mous où se posent des problèmes complexes liés aux déformations des structures anatomiques et à la définition de référentiels communs aux différents stades d’observation (pré-, per- et post-opératoires). Par ailleurs le caractère attractif de la simulation sur ordinateur – dont le degré de maturité s’est traduit par l’émergence du concept de réalité virtuelle – est lié à la possibilité de recréer artificiellement des conditions expérimentales réelles, voire de faire cohabiter des objets (ou conditions, environnements) de synthèse avec des objets (ou conditions, environnements) réels dans un même espace perceptuel.
Moyennant la mise en œuvre d’interfaces homme/machine adaptées, la réalité virtuelle (RV) permet de résoudre des problèmes complexes au travers d’un cadre méthodologique et technologique, dont l’utilisateur fait partie intégrante et assure les fonctions décisionnelles les plus critiques. Ainsi, la notion d’environnement virtuel (EV), dont l’expression semble moins antinomique, peut se définir comme un outil permettant d’opérer une simulation interactive, par la création d’objets et leur manipulation, lui conférant un haut degré de réalisme. Les environnements actuels mettent en jeu la vision, l’audition et le toucher ; les recherches se concentrent ainsi sur les capteurs de position, les gants sensitifs, les dispositifs de vision stéréoscopique ou non, les systèmes de retour d’effort, et plus généralement les systèmes immersifs. L’utilisateur, placé au cœur du dispositif, détermine la manière dont son environnement évolue. Cette approche pragmatique du domaine peut sembler restrictive compte tenu de la multiplicité des champs d’application (militaire ou spatial, robotique, biologie, finance, …) mais nous paraît plus fidèle à nos préoccupations.
Eléments d’anatomie vasculaire
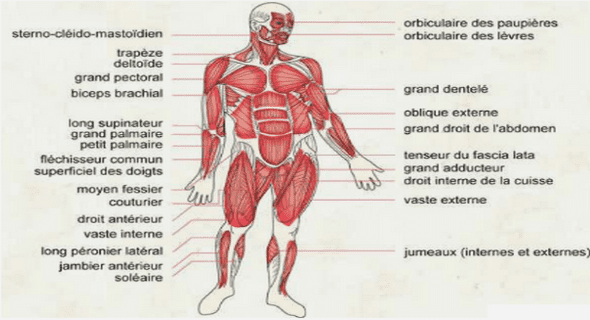
Les vaisseaux sanguins sont des structures tubulaires complexes qui en font des organes à part entière. Ils sont de trois types : artères, veines et vaisseaux lymphatiques. Les artères sont des vaisseaux qui partent du coeur et amènent le sang aux organes. Les fibres musculaires et les fibres élastiques composant leur paroi permettent de résister aux à-coups tensionnels et de maintenir un apport sanguin pendant les différentes phases du cycle cardiaque. La structure des artères change au fur et à mesure que l’on s’éloigne du coeur : la composante élastique, d’abord majoritaire, diminue de manière importante au profit des couches musculaires. Les artères se divisent en artérioles qui elles-même donnent de plus petites branches, les capillaires. Ceux-ci connectent les artères et les veines en formant un réseau dense présent dans presque tous les tissus. Les capillaires fusionnent pour former les veinules, lesquelles constituent ensuite les veines. Les veines collectent le sang des tissus et le ramènent vers le coeur [Mari93].
Les différentes portions de l’aorte sont nommées conformément à leur forme ou à leur localisation. La première, l’aorte ascendante, chemine en arrière et à droite du tronc pulmonaire. Au bout de 5 cm, elle se courbe vers la gauche et en arrière forme la crosse de l’aorte. Les seules branches de l’aorte ascendante sont les artères coronaires droite et gauche. La crosse de l’aorte est située en arrière du sternum. Ses trois principales branches sont, de droite à gauche : i) le tronc artériel brachio céphalique, qui passe en arrière de l’extrémité médiale de la clavicule droite et donne l’artère carotide commune droite et l’artère subclavière droite. ii) l’artère carotide commune gauche et iii) l’artère subclavière gauche. Ces trois vaisseaux irriguent la tête, le cou, les membres supérieurs et une partie de la paroi thoracique.
La sténose athéromateuse
La première manifestation de l’athérosclérose est la plaque athéromateuse. Elle apparaît sous la forme d’une chape fibreuse recouvrant un coeur comprenant macrophages, débris cellulaires et cristaux de cholestérol. Autour de ce noyau existent des cellules, notamment des cellules musculaires lisses et des macrophages provenant du sang circulant. Les plaques se développent lentement sur plusieurs années de vie, avec l’accumulation de lipides et lipoproteines dans les couches intimale et sous-intimale des artères. Une fibrose peut ensuite apparaître ainsi que des ulcérations ou des calcifications. Les conséquences pathologiques peuvent demeurer longtemps asymptomatiques ou se révéler soudainement. En effet, le flux sanguin peut être progressivement diminué par des plaques faisant saillie dans la lumière ou bien stoppé brutalement par détachement d’un fragment de plaque ou par constitution d’un thrombus en regard de la plaque . Le diagnostic précoce de l’athérosclérose doit permettre d’en limiter les conséquences. Sa prévention repose sur le contrôle ou la détection des principaux facteurs de risque : l’hypercholestérolémie, le tabagisme, le stress, la sédentarité, le diabète, l’obésité, l’hypertension artérielle et également les facteurs génétiques [Suck91].
La sténose athéromateuse est caractérisée par un épaississement des parois des artères de grand et moyen calibre, qui se traduit par une diminution de la lumière du vaisseau. La modification n’est pas uniforme et touche de préférence les bifurcations et les parties incurvées. Elle évolue en 3 stades [Rhod80, Suck91] :
– La plaque d’athérome se constitue dans la paroi artérielle par accumulation de dépôts lipidiques et formation de tissus fibreux. Cette plaque fait saillie dans la lumière de l’artère, engendrant des turbulences à l’origine de traumatismes, participant à leur tour au développement de la plaque. Au fur et à mesure cette plaque se calcifie et devient de plus en plus dure.
– Le développement de la plaque d’athérome aboutit à une obstruction de plus en plus importante de la lumière artérielle, avec diminution de l’irrigation des territoires en aval, phénomène responsable d’angine de poitrine, ou de crampes à la marche par exemple.
– La sténose est telle qu’elle entraîne une stagnation du flux sanguin à l’origine de la formation d’un thrombus obstruant complètement l’artère et entraînant l’ischémie des tissus en aval ( myocarde, tissus cérébraux ou membres). Par ailleurs, la plaque d’athérome étant fragile en surface, des fragments peuvent s’en détacher et ainsi libérés, aller obstruer des artères plus petites : cerveau (hémiplégie), coeur (infarctus). Les conséquences cliniques commencent généralement à apparaître vers l’âge de 40 à 50 ans quand le niveau critique d’obstruction de l’artère (70 à 80%) est atteint et que le métabolisme cellulaire fonctionne en hypoxie. Le rapport des diamètres ou des surfaces de la lumière mesurés en zone saine et dans la zone où la sténose est la plus serrée permet de définir le degré de sténose. Plusieurs modalités d’imagerie peuvent être utilisées pour le mesurer. L’angiographie reste la référence malgré certains inconvénients. Du point de vue diagnostique il s’agit d’un geste relativement invasif. L’injection de produit de contraste peut entraîner une insuffisance rénale ou être responsable d’une allergie. Par ailleurs, le nombre d’incidences d’acquisition réalisées de routine clinique est limité et les images retenues ne mettent pas forcément en évidence la sténose maximale [Sato98]. Ses indications ont diminué depuis quelques années au profit d’autres modalités (écho-Doppler, TDM, IRM).
|
Table des matières
Introduction
1 Traitement mini-invasif des lésions vasculaires
1.1 Eléments d’anatomie vasculaire
1.2 La sténose athéromateuse
1.3 Anévrismes de l’aorte abdominale (AAA)
1.4 Différentes modalités de traitement chirurgical
1.4.1 Angioplastie Transluminale (ATL)
1.4.2 Stents
1.4.3 Endoprothèses aortiques
1.4.4 Brachythérapie Endovasculaire
1.5 La planification des procédures endovasculaires
1.6 Bilan
I État de l’art
2 Réalité virtuelle en médecine
2.1 Généralités
2.2 Simulation en chirurgie
2.2.1 Modélisation et simulation
2.2.2 Réalisation pratique
2.3 Endoscopie virtuelle : une application de l’imagerie virtuelle
2.3.1 De la visualisation diagnostique à l’analyse de données
2.3.2 Vers une utilisation clinique
2.4 Bilan
3 Endoscopie virtuelle et navigation
3.1 Visualisation
3.1.1 Temps de calcul des images endoscopiques
3.1.2 Enrichissement de l’information visuelle
3.2 Les principes de la navigation
3.2.1 La planification de trajectoires
3.2.2 La Navigation active
3.2.3 Mise en correspondance de l’information des images virtuelles et réelles
3.3 L’analyse de structures
3.4 Évaluation et validation de l’endoscopie virtuelle
3.5 Bilan
4 Les interactions outils-tissus
4.1 Types d’interaction outils-tissus
4.1.1 Interaction Mécanique
4.1.2 Interaction thermique : ablation par radiofréquence
4.1.3 Interaction par irradiation : radiothérapie
4.2 Modélisation de tissus mous
4.2.1 Modèle biomécanique
4.2.2 Cadre expérimental
4.2.3 Représentation des structures déformables
4.3 Modèles déformables
4.3.1 Modèles basés sur la forme (géométriques)
4.3.2 Modèles physiques
4.3.3 Masses-Ressorts
4.3.4 Modèles combinés
4.4 Événements dans l’environnement virtuel de simulation
4.4.1 Gestion de collisions
4.4.2 Changement de topologie
4.5 Bilan
II Navigation exploratoire virtuelle et description des données patient
5 Méthodologie proposée
5.1 Analyse de la structure vasculaire
5.2 Éléments de simulation des interactions outils-tissus
5.3 Évaluation et application
6 Analyse de structures vasculaires par navigation exploratoire virtuelle
6.1 Capteur virtuel élémentaire
6.2 Extension du modèle du capteur
6.2.1 Extension des facultés perceptuelles
6.2.2 Extension du modèle du capteur virtuel
6.3 Stratégie de déplacement
6.3.1 Navigation interactive (semi-automatique)
6.3.2 Application en navigation interactive
6.3.3 Navigation active
6.4 Bilan
7 Description des données patient
7.1 Extraction de la structure
7.1.1 Représentation par maillage polygonal
7.1.2 Construction du maillage par le capteur virtuel
7.1.3 Les bifurcations
7.2 Description géométrique
7.2.1 Longueur, périmètre et section
7.2.2 Facteur de Circularité
7.2.3 Tortuosité
7.2.4 Parallélisme de la paroi
7.2.5 Angulation
7.3 Analyse pariétale
7.4 Bilan
8 Évaluation de la méthodologie
8.1 Évaluation sur modèle animal
8.1.1 Conditions d’observation : acquisition de données et dissection
8.1.2 Analyse comparative
8.1.3 Résultats
8.2 Évaluation sur des données patient
8.2.1 Analyse comparative
8.2.2 Choix d’endoprothèse et planning
8.3 Discussion
Conclusion
![]() Télécharger le rapport complet
Télécharger le rapport complet