Origine, diffusion et classification du sorgho
Le sorgho fait partie du groupe des plantes les plus anciennement cultivées dans le monde. Les avis sont partagés quant à son origine et à l’époque de sa domestication. Ainsi les peupla des Mandées qui vivent aux alentours du Niger peuvent avoir domestiqué le sorgho selon Murdock (1959). Doggett (1965) signale des faits archéologiques laissant à penser que la pratique de la domestication des céréales a été introduite en Egypte à partir de l’Ethiopie, pays d’origine vraisemblable du sorgho, environ 3000 ans avant Jésus Christ. De nombreuses données archéologiques et botaniques désignent la zone soudano-sahélienne au sud-est du Sahara comme l’aire de la domestication du sorgho (Chantereau et al., 2013). Les études relatives à l’introgression montrent que les sorghos cultivés sont probablement apparus à la faveur d’une sélection disruptive (Dogget, 1988). Ils dériveraient de la sous espèce Arundinaceum et la race Verticilliflorum. Lorsque l’homme a commencé à sélectionner, il y a eu un important écoulement de gènes entre types améliorés et types non améliorés (House, 1987). C’est ainsi quele sorgho cultivé serait arrivé dans la péninsule arabique aux environ de 2500 ans avant J.C, en Inde autour de 2000 ans avant J.C et en Chine au troisième millénaire avant J.C (Chantereau et al., 2013). Le sorgho serait arrivé en Europe au premier siècle avant J.C, et en Amérique à l’époque du commerce triangulaire (Chantereau et al., 2013). La stérilité male cytoplasmique du sorgho découverte au XXème siècle a permis le développement des sorghos hybrides en 1950, d’où l’extension du sorgho dans les pays comme l’Argentine, le Brésil, la France et l’Australie. Le sorgho (Sorghum bicolor L. Moench), est une herbacée annuelle de la famille des poaceae (ex-Graminées), sous famille des Panicoïdeae, tribu des Andropogoneae et du genre Sorghum (Dogget, 1988). C’est une espèce monoïque préférentiellement autogame. La taxonomie moderne ne reprend le nom qu’à partir de Linné qui fut le premier à décrire le sorgho en 1753. Celui-ci désigne le sorgho sous le nom de Holcus, et décrit sept (07) espèces, dont trois (03) font toujours partie du genre Sorghum : Holcussaccaratus, Holcussorghum et Holcusbicolor. Toutefois, la systématique actuelle s’inspire des bases données par Moench qui fut le premier à définir le genre Sorghum et l’espèce bicolor (L.) Moench. Harlan et De Wet (1972) ont proposé une classification simplifiée des sorghos cultivés. Pour ces auteurs, le sorgho cultivé présente une très grande diversité de formes décrites par différentes classifications botaniques. La plus simple étant basée sur la structure de l’épillet sessile (forme du grain) et du type de l’inflorescence (Figure 1). Cinq (05) races principales sont distinguées :
– La race bicolor, répartie dans l’ensemble des zones de culture du sorgho en Afrique et en Asie.
– La race caudatum bien représentée en Afrique Centrale (Soudan, Tchad et Nigéria) et en Afrique de l’Est (Ouganda)
– La race durra, majoritaire en Inde et au Moyen-Orient et très présente en Afrique de l’Est. Elle est associée au monde musulman.
– La race guinea est typique de l’Afrique de l’Ouest mais également présente en Afrique de l’Est et du Sud
– La race kafir est essentiellement présente en Afrique du Sud et de l’Est (au sud de la Tanzanie).
Des races intermédiaires sont des hybrides biraciaux aux caractères intermédiaires de ceux des races principales, pris deux à deux à savoir Guinea-Caudatum ; Guinea-Durra ; GuineaBicolor ; Guinea-Kafir ; Caudatum-Bicolor ; Caudatum-Durra ; Kafir-Caudatum ; DurraKafir ; Durra-Bicolor ; Kafir-Bicolor (Chantereau, 1994).
Quelques contraintes liées à la production du sorgho
Les contraintes sont essentiellement liées aux insectes ravageurs, aux maladies, aux mauvaises herbes (surtout le Striga) et aux oiseaux. Les insectes posent un sérieux problème pour la culture du sorgho. La mouche des pousses du sorgho (Atherigona soccota) peut causer des dégâts sévères à la culture à certaines époques de l’année. Les punaises des panicules peuvent causer des dégâts importants lorsque les populations sont nombreuses sur les panicules. Une petite mouche, la cécidomyie (Stenodiplosis sorghicola) est signalée comme le ravageur le plus important de la culture du sorgho dans le monde. Il constitue l’ennemi majeur de cette culture surtout dans les zones sud, centre-ouest et Est du Burkina Faso avec des pertes en rendement pouvant atteindre 33 %. Au Burkina Faso, la solution aux problèmes posés par cet insecte ravageur a d’abord reposé sur l’utilisation des variétés résistantes mises au point par l’ICRISAT. Malheureusement, celles-ci se sont avérées inadaptées aux conditions du pays, en raison de leur sensibilité à d’autres contraintes biotiques (maladies foliaires, moisissures des grains et punaises des panicules). Les maladies les plus importantes du sorgho sont les moisissures des grains, le mildiou (Peronosclerospora sorghi), la pourriture charbonneuse (Macrophornina phaseolina) et l’anthracnose (Colletotrichum graminicola). Appelé sêgê en jula, zeeme ou waongo en moré, le striga (Striga hermonthica) est la mauvaise herbe qui parasite le sorgho surtout au Burkina Faso. Il est même un facteur limitant à la production du sorgho dans certaines régions du pays. Le striga lève pendant la montaison du sorgho et fleurit pendant sa maturation. Le quelea à bec rouge (Quelea quelea) est considéré comme l’un des principaux et dangereux prédateurs aviaires du monde (Bruggers et Jaeger, 1982). Cet oiseau se nourrit normalement des grains de graminées sauvages, mais peut provoquer d’importants dégâts dans les cultures de sorgho en cours de maturation.
Interception de la lumière par un couvert
Le rayonnement solaire global représente la somme des rayonnements direct et diffus dans la gamme de longueur d’onde 300-3000 nm. Toutes les radiations du spectre solaire ne peuvent être utilisées par les organes chlorophylliens. La conversion de l’énergie des photons incidents en énergie chimique par l’appareil photosynthétique d’une feuille n’est réalisée que pour les rayonnements ayant une longueur d’onde comprise entre 350 et 750 nm environ, et avec une efficacité très variable dans cet intervalle. Ainsi de nombreux auteurs (Gabrielsen, 1940 ; Gaastra, 1959 ; Nichiporovich, 1960 ; Mccree, 1966) ont posé le problème de la définition du rayonnement utile pour la photosynthèse. Depuis les travaux de Mccree (1972 ; 1973), la gamme 400-700 nm est communément admise pour définir le rayonnement utile à la photosynthèse, même si les spectres d’action peuvent présenter quelques divergences entre espèces, notamment entre plantes ligneuses et herbacées (Clark et Lister, 1975 ; Inada, 1978). Le sigle PAR (Photosynthetically Active Radiation) est actuellement le plus répandu pour désigner le rayonnement utile à la photosynthèse (RPA : Rayonnement Photo synthétiquement Actif ou RUP : Rayonnement Utile à la Photosynthèse). Les travaux de Mccree (1972 ; 1973) ont montré aussi une meilleure proportionnalité entre l’intensité de la photosynthèse et le PAR lorsque celui-ci est caractérisé en nombre de photons plutôt que par son énergie. Le couvert végétal n’absorbe pas tout le rayonnement solaire qu’il reçoit : une partie est réfléchie vers l’atmosphère et une autre est transmise au sol qui à son tour en renvoie une part vers la végétation. Tous les rayonnements sont donc mesurés ou estimés (dans le cadre de modèle d’interception par exemple) sur un plan horizontal. Selon (Varlet Grancher et Bonhomme, 1974 ; Hodge et Kanemasu, 1977), le rayonnement absorbé par la végétation(Rga) est déterminé par le bilan entre les rayonnements reçus : rayonnement incident (Rgo) et rayonnement réfléchi par le sol (Rg’), et les rayonnements « perdus » : rayonnement réfléchi par l’ensemble sol-culture (Rgr) et rayonnement transmis au sol (Rgt). Depuis longtemps, différents auteurs ont essayé d’analyser la croissance en matière sèche d’un couvert végétal par rapport au rayonnement solaire (Kamel, 1958 ; Shibles et Weber, 1965 ; Monteith, 1972). L’utilisation de cette méthode s’est généralisée et de nombreux auteurs (Bonhomme et al., 1982 ; Gosse et al., 1984 ; Howell et Musick, 1984 ; Martin, 1986) présentent des relations entre la production de matière sèche et la quantité de rayonnement solaire absorbée ou interceptée par une culture. La détermination du LAI d’un couvert permet donc de connaître la vitesse de fermeture dudit couvert, et la croissance d’une culture peut être ainsi facilement quantifiée.
Densité foliaire et orientation des feuilles
La densité foliaire correspond à l’indice foliaire par unité de volume végétal considéré. Sinoquet et Bonhomme (1989), ont observé que pour un couvert de maïs, suivant le stade considéré, le maximum de densité foliaire se situe à une hauteur de 40 à 70% de la hauteur totale des pieds. Les variations de LAI dans le plan horizontal peuvent aussi être importantes. Pour (Ross, 1981 ; Myneni et al., 1986 ; Sinoquet et al. 1991), ces variations sont principalement dues à l’agencement des feuilles autour des tiges qui entraîne une densité foliaire plus importante au niveau des rangs que des inters rangs. L’orientation des feuilles détermine en grande partie la surface réellement réceptrice du rayonnement, c’est donc un paramètre de structure primordial. Les feuilles d’un couvert peuvent avoir des inclinaisons variables selon l’espèce et les contraintes du milieu (lumière disponible, stress hydrique.). Six distributions standard couramment nommées Leaf Angle Distribution (LAD) (de Witt, 1965) ont été définies :
– Planophile : les feuilles horizontales y sont les plus fréquentes (couvert de soja par exemple),
– Erectophile : les feuilles dressées sont les plus fréquentes (céréales),
– Plagiophile : les feuilles inclinées à 45° sont les plus fréquentes (vigne),
– Extremophile : les feuilles ont deux orientations possibles : horizontale et verticale,
– Uniforme : la probabilité d’inclinaison des feuilles est la même, quel que soit l’angle d’inclinaison considéré,
– Sphérique : la fréquence d’occurrence des angles foliaires est celle qu’auraient des feuilles placées à la surface d’une sphère
Détermination de la surface foliaire
Chez les graminées, la feuille est constituée d’un limbe et d’une gaine qui entoure la tige et recouvre parfois partiellement celle de la feuille suivante. La ligule marque la séparation entre le limbe et la gaine. Le limbe est la partie qui assure l’essentiel de l’interception du rayonnement et de la photosynthèse. Les feuilles ont fini leur croissance lorsque leur ligule est apparue. La mesure directe non destructive de la surface des feuilles ligulées est possible à l’aide de planimètre de terrain, mais leur emploi cause souvent des dommages à la culture. Celle des feuilles en croissance n’est pas possible, en raison de leur disposition en cornet et de leur emboîtement. Chez le sorgho la forme des feuilles est lancéolée et la plus grande partie de la surface foliaire est glabre avec parfois un dépôt cireux assez prononcé qui jouerait un rôle protecteur contre l’excès de rayonnement solaire. Estimer l’évolution de la surface des feuilles à partir de comptage de feuilles pendant leur apparition et de mesures à la fin de leur croissance évite de toucher les feuilles pendant leur croissance donc minimise les stress liés à la manipulation des plantes ou des feuilles, tels que les ont mis en évidence Beardsell (1977) sur le maïs : des mesures quotidiennes de feuilles réduisaient significativement les poids de tige et les hauteurs de plante. Après la collecte des feuilles, la surface foliaire est le plus souvent déterminée par planimétrie ou gravimétrie.
Planimétrie : La surface de chaque feuille est déterminée directement après passage au planimètre. Pour ce qui concerne notre étude nous avions utilisé un scanner Taotonics (Photo 3) en lieu et place du planimètre afin de déterminer nos surfaces foliaires. Il faut signaler que la méthode du planimètre n’est appliquée que si le volume d’échantillon à planimétrer n’est pas trop important.
Gravimétrie : La méthode de gravimétrie consiste à relier la surface foliaire d’une espèce à son poids sec par détermination de la surface spécifique des feuilles (SSF en cm²/g). Seule une partie de l’échantillon collecté est passée au planimètre, puis placée dans une étuve (pendant environ 48h à 70°C) et pesée avec une balance de précision. Cette méthode est très utilisée lorsque le LAI doit être estimé à partir d’un nombre important d’échantillons. Une autre méthode de mesure directe que nous avons utilisée est celle du calcul de LAI à travers la détermination de la surface foliaire par la mesure des dimensions de la feuille. La forme des feuilles a été décrite par des expressions analytiques reliant longueur et largeur (arcs de parabole : Bonhomme et Varlet-Grancher, 1978 ; Prévot et al., 1991 ; arcs de sinusoïdes : Edmeades et Daynard, 1979 ; Sanderson et al., 1981), qui, par intégration, permettent de calculer leur surface. Au contraire, l’estimation de la surface des feuilles en croissance est rarement abordée séparément (Dwyer et Stewart, 1986 ; Muchow et Carberry, 1989) car elle nécessite des mesures supplémentaires.Ces méthodes directes d’estimation du LAI sont coûteuses en temps et en main d’œuvre car, pour être précises, elles nécessitent la collecte d’un grand nombre d’échantillons. Elles ne sont donc pas très appropriées si on veut effectuer un échantillonnage spatial très étendu ou un suivi des variations temporelles de LAI. Elles sont néanmoins indispensables pour la validation et la calibration des méthodes de mesure indirectes.
Effet des méthodes sur la mesure du LAI au cours du cycle de développement
Les résultats de l’analyse des effets des méthodes sur le LAI au cours du cycle de développement ont montré qu’il n’y a pas de différence significative entre les méthodes au 40ème, 65ème, 77ème, et 93ème Jour Après Semis (JAS). Cependant au 30ème JAS (stade 6 feuilles ligulées) et au 51ème JAS (stade 12 feuilles ligulées) l’analyse a révélé des différences significatives (tableau V et VI). Ainsi au 30ème JAS il ressort que la méthode M2 est significativement différente des autres méthodes. On remarque une surestimation du LAI avec la méthode M2 en début de saison due probablement aux faibles radiations mesurées en dessous des plantes. Etant donné qu’à cette période les plantes sont encore petites et que les organes aériens notamment les feuilles ne permettent pas une bonne couverture du sol, la radiation mesurée en dessous de la plante sera plus ou moins égale à celle mesurée au-dessus de la plante engendrant une surestimation du LAI. Ces résultats sont en accord avec ceux trouvés par Nadia EL Khadji (2008) qui a montré que toutes les méthodes empiriques mais aussi le LAI-2000 présentait un problème de surestimation du LAI au début de la croissance végétative et plus particulièrement chez le blé et le maïs. Ce qui pourrait être le cas aussi pour le sorgho. Ceci nous permet d’affirmer qu’en début de saison, le LAI-2000 n’est pas approprié pour estimer le LAI. Au regard de nos résultats nous pouvons dire qu’au cours du cycle de développement c’est-à-dire du 40ème jusqu’au 93ème JAS toutes les méthodes seraient appropriées pour l’estimation du LAI. Jonckheere et al., (2004) ont plutôt montré qu’en plein cycle de développement le LAI estimé par le LAI-2000 est inférieur à celui estimé par les méthodes directes et qu’il y a saturation du LAI lorsque celui-ci atteint la valeur 5. Cependant au 51ème JAS la méthode M3 a montré une différence significative avec la méthode M0. Cette différence observée est due à une légère sous-estimation du LAI par le ceptomètre « sunscan » ; ce qui témoigne les travaux de Futahuchi et al., (2009) qui ont montré que le LAI estimé avec le sunscan était significativement différent (R² = 0,96) de celui obtenu par la méthode destructive. Selon Campbell (1986) les risques d’erreur avec le sunscan augmentent pour des éléments (feuilles) verticaux et un soleil bas (hauteur zénithale du soleil trop basse). Or pour notre mesure du 51ème JAS, cette hauteur zénithale était très différente de celle des autres dates de mesure ; ce qui a nécessairement conduit à une sous-estimation du LAI. En plus du fait qu’il n’y a pas eu de différence significative entre les méthodes au cours du cycle de développement or mis les 30ème et 51ème JAS, on remarque que les deux méthodes directes (M0 et M1) sont plus proches entre elles. Cet état de fait pourrait s’expliquer par la nature de la variable mesurée. En effet dans le calcul du LAI, ces deux méthodes ont en commun les feuilles vertes et ligulées comme variable mesurée. Pour ce qui est des méthodes indirects (M2 et M3) elles sont également similaire entre elles concernant l’estimation du LAI Cela est imputable au principe et à la logique des instruments de mesures. La variable commune mesurée dans ce cas n’est plus les feuilles vertes et ligulées mais plutôt la transmittance dans le couvert. Le LAI estimé par ces appareils tient compte non seulement du feuillage mais aussi des autres organes de la plante tels que la tige et l’ombrage ce qui biaise les estimations du LAI. Raison pour laquelle certains auteurs comme Asner et al., (2003) pensent que pour de telles méthodes, une autre définition du LAI est plutôt de mise comme celle du LAI projeté horizontalement ou « LAI vert » ou encore PAI (Plant Area Index).
|
Table des matières
Introduction générale
Chapitre 1 : Synthèse Bibliographique
1.1.Généralités sur le sorgho
1.1.1. Origine, diffusion et classification du sorgho
1.1.2 Morphologie du sorgho
1.1.3. Physiologie du sorgho
1.1.4. Besoins environnementaux
1.1.5. Quelques contraintes liées à la production du sorgho
1.2. Généralité sur le LAI (Leaf Area Index) ou Indice foliaire
1.2.1. Définition
1.2.2. Interception de la lumière par un couvert
1.2.3. Rôle fonctionnel du LAI
1.2.4. Quelques paramètres influençant le LAI
1.2.4.1. Densité foliaire et orientation des feuilles
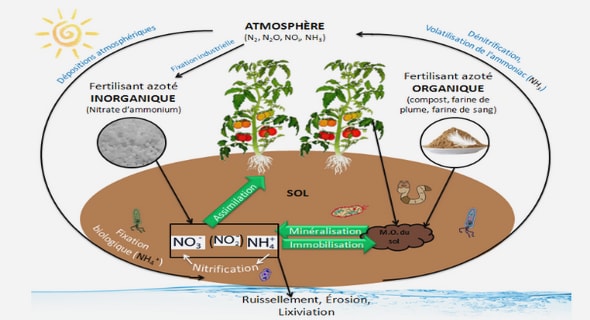
1.2.4.2. Teneur en eau et élément minéraux du sol
1.2.4.3. La variété culturale
1.2.5 Mesures de LAI
1.2.5.1. Les méthodes directes
1.2.5.1.1. Collecte des feuilles
1.2.5.1.2. Détermination de la surface foliaire
1.2.4.2. Les méthodes indirectes
Chapitre 2 : Matériel et méthodes
2.1. Présentation de la zone d’étude
2.1.1. Site d’expérimentation
2.1.2. Climat
2.1.3. Végétation
2.1.4. Sols
2.2. Matériel d’étude
2.2.1. Matériel végétal
2.2.2. Matériel de mesures
2.2.2.1. LAI-2000
2.2.2.2. Sunscan
2.2.2.3. Scanneur
2.2.2.4. Le ruban métrique
2.3. Méthode d’étude
2.3.1. Description du dispositif expérimental
2.3.2. Itinéraire culturale
2.3.3. Collecte des données
2.3.3.1. Paramètres agronomiques mesurés
2.3.3.2. Mesures de LAI
2.4. Traitement et Analyse des données
2.4.1. Interaction entre variété et méthode de mesure du LAI au stade Feuille Drapeau
2.4.2. Effet des méthodes sur le LAI en cours du cycle de développement
2.4.3. Corrélation entre méthodes et quelques paramètres simples de mesures
Chapitre 3 : Résultats et Discussion
3.1. Résultats
3.1.1. Interaction entre variété et méthode de mesure du LAI au stade Feuille Drapeau
3.1.2. Effet des méthodes sur la mesure du LAI au cours du cycle de développement
3.1.3. Corrélation entre le LAI et quelques paramètres simples de mesures
3.2. Discussion
3.2.1. Effet des méthodes sur la mesure du LAI au cours du cycle de développement
3.2.2. Interaction entre variété et méthode de mesure du LAI au stade Feuille Drapeau
3.2.3. Corrélation entre le LAI et quelques paramètres de croissance de la plante
Conclusion et perspectives
![]() Télécharger le rapport complet
Télécharger le rapport complet