Télécharger le fichier pdf d’un mémoire de fin d’études
Rôles du silicium et du germanium en chimie
Lorsqu’on lui parle de silicium, le chimiste organicien pensera au premier abord aux groupements protecteurs et éventuellement à la silice sur laquelle il purifie ses composés. La participation du silicium en chimie organique est toutefois beaucoup plus importante, car elle a pu conduire au développement d’un certain nombre de réactions largement utilisées en synthèse telles que par exemple : la réaction de Sakurai,12 l’oléfination de Peterson,13 le réarrangement de Brook14 ou le couplage de Hiyama.15
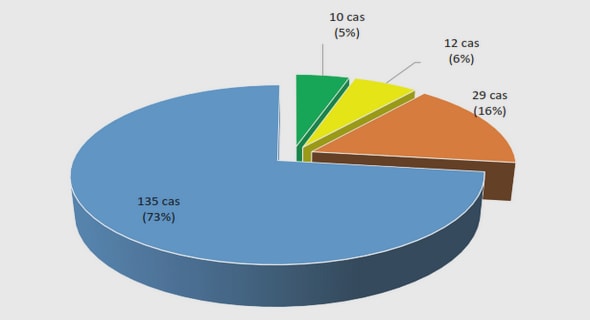
De nos jours, la chimie du germanium n’a pas encore connu un essor similaire à celui du silicium. Néanmoins, la chimie des organogermanes se développe rapidement, ils sont vus comme une solution alternative et complémentaire aux réactifs nucléophiles (organozinciques, organomagnésiens, acides boroniques, organostannanes et organosilanes) traditionnellement utilisés dans les réactions de couplages-croisés catalysés au palladium. Schéma 6 : Date du premier article mentionnant le couplage croisé
Les organozinciques, les organomagnésiens, les acides boroniques et les organostannanes ont largement été utilisés dans les réactions de couplages catalysées par le palladium ou le nickel pour la formation de la liaison carbone-carbone.
Par exemple, les organozinciques (RZnX) et les organomagnésiens aromatiques (ArMgX) sont respectivement utilisés dans les réactions de couplage de Negishi17 et Kumada.18
Les organozinciques sont peu réactifs et tolèrent beaucoup mieux les groupements fonctionnels. Les organomagnésiens sont, quant à eux connus pour leur très forte réactivité et de ce fait tolèrent moins certains groupements fonctionnels. Le couplage de Suzuki19 implique des acides boroniques aromatiques ArB(OH)2 et des halogénures ou de triflate d’aryle. Les acides boroniques sont souvent remplacés par des esters boroniques. 20 Quant aux organostannanes RSnR3, ils sont utilisés dans les réactions de couplage de Stille mais leur toxicité21 limite leur utilisation.
Les organozinciques dans l’activation de liaisons Si–H et Ge–H
Durant mes travaux de thèse, les dialkylzincs ont été les réactifs le plus utilisés. Ils offrent facilement l’accès à des intermédiaires valorisables, difficilement obtenus par d’autres voies d’accès. Dans cette partie, nous allons brièvement introduire la chimie des organozinciques et leurs utilisations dans les processus d’activation de liaisons Si–H et Ge– H.
Les organozinciques sont des composés organométalliques présentant une liaison C–Zn.47 Le diéthylzinc (Et2Zn) est le premier organozincique à avoir été synthétisé par Edward Frankland en 1848 à partir d’iodoéthane et du zinc métal.48 Les organozinciques sont moins réactifs que leurs homologues lithiés et magnésiés. Ils sont sensibles aux sources de proton (tels l’eau et les alcools) et à l’oxygène.49 Deux familles de dérivés organométalliques du zinc sont principalement utilisées en chimie organique : les halogénures de zinc (RZnX) et les diorganozinciques (R2Zn). Ils peuvent être obtenus, en outre par des réactions d’insertion ou transmétallation à partir d’organolithiens ou d’organomagnésiens (Schéma 16).
Les voies d’accès aux hétérocycles germanylés
L’hydrogermylation peut être réalisée à l’aide d’acides de Lewis (voie A),19 de complexes de métaux de transition (rhodium,20 platine,21 palladium22 et ruthénium23) (voie B) ou d’initiateurs radicalaires (voie C).24 L’hydrogermylation peut également être promue par des dialkylzincs (voie D).25 Le chauffage aux micro-ondes et aux ultrasons permettent aussi de réaliser des réactions d’hydrogermylation directement.26
En 1997, Lucarini et Chatgilialoglu ont décrit un exemple de trans-hydrogermylation radicalaire d’alcynes à l’aide du tris(trimethylsilyl)germane II-95.37 Avec des alcynes activés, comme le phénylacetylène II-96 et le méthyl propiolate II-97, les vinylgermanes issus d’une trans-addition anti-Markovnikov ont été obtenus sans ajout d’initiateur radicalaire au mélange réactionnel (Schéma 25).
Les dialkylzincs ont été récemment utilisés par le groupe de recherches de Perez-Luna pour activer la liaison Ge–H et promouvoir l’addition de la liaison Ge–Zn sur la triple liaison d’alcynes.25 Le premier exemple de germylzincation a été réalisé sur des ynamides terminales et internes ainsi que d’autres alcynes substitués par du soufre, de l’oxygène et du phosphore. Ces derniers en présence de germanes et de diéthylzinc conduisent aux intermédiaires vinylzincs (Schéma 31). Une hydrolyse ou une fonctionnalisation des différents intermédiaires vinylzincs issus de la germylzincation a conduit aux vinylgermanes II-116 — II-119 diversement substitués et sélectivement issus d’une cis-addition anti-Markovnikov favorisée par la chélation du zinc par la fonction amide. Ces produits ont été obtenus dans un ratio b / a > 98 / 2.
Notons que le chauffage permet d’accélérer la formation de l’intermédiaire germylzinc II-177 afin d’avoir une conversion totale et réduire le temps de la réaction.
Le germane II-183 présentant un groupement phényle en position acétylénique a été préparé en deux étapes depuis l’iodophénol II-142. Ce dernier a été tout d’abord condensé dans une réaction de Mitsunobu, sur le phenylprop-2-yn-1-ol conduisant à l’éther II-182 qui est ensuite engagé dans nos conditions de germylation pour donner le germane II-183 (Schéma 56).
|
Table des matières
Premier Chapitre INTRODUCTION GENERALE
I. Introduction
II. Le silicium et le germanium en chimie médicinale
III. La thérapie au silicium et au germanium
IV. Rôles du silicium et du germanium en chimie
V. Exemples de synthèse d’hétérocycles silylés et germanylés
A. Hétérocycles silylés et germanylés par un réarrangement anionique
B. Silylation et germylation déshydrogénative d’une liaison C(sp3 )—H
VI. Les organozinciques dans l’activation de liaisons Si–H et Ge–H
VII. État de l’art et projet de thèse
Deuxième Chapitre SILYLZINCATION / GERMYLZINCATION INTRAMOLECULAIRE D’ALCYNES
Partie : Études bibliographiques
I. Introduction
II. Les voies d’accès aux hétérocycles germanylés
A. Accès par substitution nucléophile
B. Accès par réarrangement anionique
C. Accès par lactonisation
D. Accès par cycloaddition en présence de germylènes
III. Formation de la liaison Ge–C par activation de la liaison Ge–H
A. Activation de la liaison Ge–H en présence d’acides de Lewis
B. Activation de la liaison Ge–H par des complexes de métaux de transition
C. Activation de la liaison Ge–H avec un initiateur radicalaire
D. Activation de la liaison Ge–H avec les dialkylzincs
Partie : Résultats et discussions
I. Silylzincation intramoléculaire d’alcynes pour la synthèse d’hétérocycles silylés
II. Germylzincation intramoléculaire d’alcynes pour la synthèse d’hétérocycles
germanylés
A. Synthèse des substrats modèles
B. Optimisation des conditions de germylzincation intramoléculaire
C. Mécanisme radicalaire ou polaire
D. Mécanisme réactionnel de la germylzincation polaire
III. Accès à des hétérocycles germanylés via l’extension de la germylzincation intramoléculaire d’alcynes
A. Étude de l’influence de la substitution en position acétylénique
1. Oxygène en b de la triple liaison avec variation de la position acétylénique
2. Carbone ou azote en b de la triple liaison avec variation de la position acétylénique
B. Étude de l’influence de la densité électronique sur le noyau aromatique
C. Extension de la germylzincation à une ényne et à un alcène
D. Variation des substituants sur le germanium
E. Annulation d’autres cycles
F. Halodegermylation de vinylgermane
IV. Valorisation de l’intermédiaire zincique issu de la cyclisation par réactiontandem
V. Hydrogermylation radicalaire initiée par l’AIBN
VI. Conclusions et Perspectives
Troisième Chapitre ACCES AUX GERMOLES PAR GERMYLZINCATION INTRAMOLECULAIRE
Partie : Études bibliographiques
I. Introduction
II. Les stratégies de synthèse des motifs siloles et germoles dans la littérature
A. Formation intermoléculaire C–E (Si, Ge)
1. La formation intermoléculaire C–Si
2. La formation intermoléculaire C–Ge
B. Formation intramoléculaire C–E (Si, Ge)
1. La formation intramoléculaire C–Si
2. La formation intramoléculaire C–Ge
C. Formation intermoléculaire C–E (Si, Ge) et C–C
1. La formation intermoléculaire C–Si et C–C
2. La formation intermoléculaire C–Ge et C–C
D. Formation intramoléculaire C–C
1. Silole via la formation intramoléculaire C–C
2. Germole via la formation intramoléculaire C–C
Partie : Résultats et discussions
I. Germylzincation intramoléculaire d’alcynes pour la synthèse de germole
A. Synthèse du substrat modèle
B. Études expérimentales des conditions germylzincation pour la synthèse de germole
C. Mécanisme radicalaire ou polaire
D. Rôle du zinc dans les processus de formation du germylzinc et de l’hydrogermylation
E. Mécanisme réactionnel proposé
II. Généralisation de l’accès à des germoles substitués via la germylzincation intramoléculaire d’alcynes
A. Étude de l’influence de la substitution en position acétylénique
1. Synthèse des substrats
2. Cyclisation
B. Étude de l’influence de la densité électronique sur le noyau aromatique
1. Groupement donneur
2. Groupement attracteur
C. Extension de la méthodologie au noyau pyridinique et à une ényne
1. Cas du noyau pyridinique
2. Cas de l’ényne
III. Valorisation de l’intermédiaire zincique issu de la cyclisation par réaction tandem
IV. Valorisation d’iodure de vinyle germole en couplage croisé
A. Couplage de Suzuki
B. Couplage de Sonogashira
V. Valorisation du germylzinc dans les réactions de couplage
VI. Conclusions et Perspectives
Quatrième Chapitre HYDROSILYLATION INTRAMOLECULAIRE D’ALCYNES
Partie : Études bibliographiques
I. Introduction
II. Les voies d’accès aux hétérocycles silylés
A. Formation de la liaison C–Si
1. Formation par silylation d’organométalliques
2. Formation par activation de la liaison Si–H
3. Formation par activation de la liaison Si–Si
B. Formation de la liaison C–C
1. Formation par activation de la liaison Si-CH2–H
2. Formation par carbométallation
C. Formation simultanée des liaisons C–Si et C–C
III. Hydrosilylation
A. Complexes de métaux de transition
B. Acides de Lewis et initiateur radicalaire
Partie : Résultats et discussions
I. Hydrosilylation intramoléculaire d’alcynes catalysée au nickel
II. Généralisation de la méthode d’hydrosilylation intramoléculaire d’alcynes
A. Étude de l’influence de la substitution en position acétylénique
B. Extension de l’hydrosilylation aux cycles à 6 chaînons
C. Variation des substituants sur le silicium
III. Conclusions et Perspectives
CONCLUSION GENERALE
Cinquième Chapitre PARTIE EXPERIMENTALE
General aspects
I. Silylzincation / Germylzincation
A. Precursors synthesis
B. Precursors silanes and germanes synthesis
C. Germylzincation
D. Halodegermylation of vinylgermane
E. Functionalization of vinylzinc intermediates
F. Hydrogermylation
II. Germoles
A. Precursors synthesis
B. Germanes synthesis
C. Germylzincation
III. Intramolecular Hydrosilylation
A. Silanes synthesis
B. Hydrosilylation
Télécharger le rapport complet