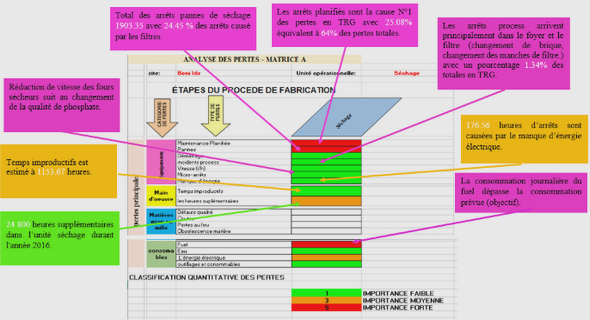
La configuration électronique (cas des éléments de transition)
Madelung12 et Klechkowski13 ont tous les deux démontré l’ordre de remplissage des souscouches électroniques. Les sous-couches s peuvent accueillir 2 électrons, les p 6 électrons, les d jusqu’à 10, les f 14 électrons et enfin les sous-couches g avec leurs 18 électrons. Le remplissage des sous-couches est aussi régi par les lois de Pauli14 et de Hund15 concernant les spins des électrons. Néanmoins, il existe de nombreuses exceptions à la règle de Klechkowski. C’est le cas du cuivre par exemple. Si nous suivions à la lettre la règle, le cuivre aurait une configuration électronique [Ar] 3d9 4s2 or il possède la configuration [Ar] 3d10 4s1 . Cela s’explique par des effets de stabilisation lorsque les couches sont totalement remplies ou à demiremplies. C’est le cas ici où un électron de la sous-couche 4s va préférer se placer sur la souscouche 3d afin d’obtenir alors une sous-couche d remplie 3d10 et une sous-couche s demiremplie 4s1 .
Ces phénomènes font que certains degrés d’oxydation sont plus courants car leurs configurations électroniques sont plus stables que d’autres. Il est important de noter que l’ionisation ne se fait pas dans le même ordre que le remplissage. Si nous prenons l’exemple du métal de transition qu’est le fer de configuration [Ar] 3d6 4s2 , la couche 4s va se remplir avant la couche 3d et perdra ses électrons en premier lors de l’ionisation étant la couche la plus à l’extérieure donc possédant des énergies d’ionisation plus faibles (Figure 1). Lorsque le fer métallique Fe0 perd un électron pour former l’ion Fe+ (instable), c’est un électron de la souscouche 4s qui est perdu. La formation du Fe2+ consiste à la perte du second électron 4s. L’ion Fe3+ est quant à lui obtenu par la perte d’un premier électron de la sous-couche 3d. Les états les plus stables et les plus communs du fer étant les états16 : 2+ et 3+. Ce dernier étant lui plus stable que le 2+.
En général, les éléments de transition situés à gauche de la colonne du fer vont perdre tous leurs électrons s puis d et adopter des états d’oxydation plus ou moins stables, comme dans le cas du manganèse pouvant aller jusqu’à 7, alors que les éléments à droite du fer auront tendance à perdre seulement leurs électrons s pour former des états d’oxydation I et II.
Ces représentations sont très simplifiées et chaque case représente une orbitale ou un niveau d’énergie. Si nous prenons les orbitales d qui sont les plus intéressantes pour les éléments de transition, les 5 orbitales possèdent la même énergie dans le modèle de l’ion libre. En réalité, dans un matériau, les orbitales subissent un phénomène appelé levée de dégénérescence. La levée de dégénérescence dépend de la symétrie adoptée. Comme les symétries les plus courantes sont les symétries tétraédriques et octaédriques nous allons prendre celles-ci en exemples pour le fer 2+ . En symétrie octaédrique, les 5 orbitales se séparent en deux niveaux d’énergie notés eg et t2g. Le niveau eg possède une plus haute énergie qui s’explique par le principe de répulsion électrostatique entre les orbitales de l’élément de transition et les doublets d’électrons des ligands. En effet, les ligands dans le cas d’une symétrie octaédrique, viennent se placer selon les axes x, y et z ce qui rend moins favorables les orbitales ??2 et ??2−?2 qui suivent ces mêmes axes. Les orbitales du niveau t2g sont plus favorables car elles induisent une répulsion moindre entre ligands et orbitales impliquant que l’énergie de ce niveau est inférieure. Dans le cas d’une symétrie tétraédrique, le scénario inverse se produit. En effet, puisque les ligands ne sont pas placés selon les axes comme dans la configuration octaédrique, cette fois-ci, ce sont les orbitales ???, ??? et ??? qui provoquent le plus d’interaction répulsive avec les ligands et sont donc moins favorables, provoquant un niveau d’énergie t2 regroupant ces 3 orbitales avec une énergie plus élevée que le niveau e composé des orbitales ??2 et ??2−?2.
De plus, pour les ions ayant une configuration de d4 à d7 (comme les Fe2+ et Fe3+), le remplissage des différents niveaux varie en fonction de l’environnement du métal de transition ce qui donne lieu à différents états de spin. Le haut spin (ou champ faible) qui implique que les électrons vont se placer dans les orbitales de manière à obtenir le plus de spins parallèles possibles . L’autre état le plus observé et connu est le bas spin (ou champ fort) qui consiste à remplir d’abord complètement les orbitales de plus basse énergie avant de commencer à remplir celles de plus haute énergie. Ces différents niveaux d’énergie et états de spin provoquent des propriétés physiques particulières qui seront développées plus loin dans cette partie.
Les effets du degré d’oxydation sur la structure adoptée
De nombreuses recherches sur l’influence du degré d’oxydation sur la formation des polyèdres de coordination existent mais il n’y a pas de règle précise qui montre que tel degré d’oxydation induit tel type d’environnement. En effet, pour un élément de transition donné avec un degré d’oxydation fixé plusieurs types de coordination sont possibles. Il y a tout de même une large majorité d’éléments qui adopte des environnements 6-octaédriques et 4-tétraédriques. Si nous prenons l’exemple du fer dans la table réalisée par Stanley-Gray et al.16 . et plus particulièrement, le fer dans son état d’oxydation II, celui-ci peut former jusqu’à pas moins de 10 polyèdres de coordination plus ou moins distordus avec les anions qui l’entourent selon le composé mais la configuration 6-octaédrique est bien plus courante (~80% des cas). Dans le cas du fer III, il y a moins de configurations possibles et 2 d’entre elles sont largement plus adoptées (~97% des cas recensés dans leur table) comme pour les autres éléments : le tétraèdre et l’octaèdre. Les données pour le fer IV ne semblent néanmoins pas à jour car celui-ci adopte souvent la configuration octaédrique dans des composés tels que les pérovskites17,18 CaFeO3 et SrFeO3 ou les composés de la famille des Ruddlesden-Popper comme Sr2FeO4 et Sr3Fe2O7.
À l’inverse, il est possible de contrôler l’état d’oxydation et l’environnement d’un élément dans un matériau en jouant sur la stœchiométrie en anions lors de la synthèse d’un composé ou en insérant un autre élément en substitution possédant un état de valence différent, c’est le cas du système La1-xSrxFeO3-δ 21. Pour x = 0, nous sommes en présence du composé LaFeO3 dans lequel le fer y est présent sous sa forme 3+. Lorsque du strontium 2+ est inséré afin de remplacer le lanthane 3+ et que la stœchiométrie en oxygène est contrôlée, le fer est contraint de changer son état d’oxydation vers un état 4+, menant à la cohabitation de deux degrés d’oxydation différents. À x = 1, dans le composé SrFeO3-δ, le fer est alors présent majoritairement sous son état 4+ lorsque les lacunes d’oxygène sont évitées au maximum (0,02 < δ < 0,26).
Une autre conséquence du changement du degré d’oxydation est l’évolution de la taille de l’élément concerné. Lorsque les atomes gagnent ou perdent des électrons de leur couche de valence, ceux-ci voient alors leur rayon ionique augmenter ou diminuer respectivement. La taille des ions jouant un rôle important dans la stabilisation d’une structure cristallographique.
Cas particulier des lanthanides
Les lanthanides représentent une famille d’éléments pour lesquels la sous-couche 4f se remplit. Cela regroupe les éléments du lanthane La au lutécium Lu. La sous-couche 4f est particulière car c’est une sous-couche interne qui se remplit après plusieurs sous-couches 5s, 5p et 6s en accord avec la règle de Klechkowski13. Les lanthanides dans leur état fondamental possèdent une configuration en [Xe] 4fN 6s2 où N varie de 0 à 14. Des exceptions à la règle de Hund15 sont en réalité observées. Le lanthane, le cérium Ce, le gadolinium Gd ont des configurations électroniques où un électron est placé dans leur sous-couche 5d du type [Xe] 4fN 5d1 6s2 où N = 0,1,7 respectivement. Le lutécium est un cas à part car celui-ci a sa sous-couche 4f rempli ce qui lui fait avoir alors une configuration électronique [Xe] 4f14 5d1 6s2 . Tous les éléments de cette famille adoptent en général un degré d’oxydation 3+ et ont tous une configuration électronique du type [Xe] 4fN avec N de 0 à 14. Trois de ces lanthanides possèdent aussi un degré d’oxydation stable et courant. Le cérium existe sous forme 4+ en perdant son dernier électron 4f afin d’avoir une sous-couche vide. L’europium peut ne perdre que ses deux électrons 6s pour garder sa sous-couche 4f à moitié remplie afin d’adopter le degré d’oxydation 2+. Le terbium quant à lui peut perdre un électron supplémentaire afin d’avoir sa sous-couche 4f à moitié remplie également et ainsi adopter un degré d’oxydation 4+.
|
Table des matières
Introduction générale
Chapitre I – Etat de l’art
I. Les états d’oxydation
I.1 La configuration électronique (cas des éléments de transition)
I.2 Les effets du degré d’oxydation sur la structure adoptée
I.3 Cas particulier des lanthanides
II. Détermination et effets sur les propriétés physiques
II.1 Les principales techniques de caractérisation des états de valence
I.1.1 La spectroscopie Mössbauer
I.1.2 La spectroscopie d’absorption de rayons X
I.1.3 La spectroscopie photoélectronique X
I.1.4 Comparaison des différentes techniques
II.2 Propriétés induites par les degrés d’oxydation
II.2.1 Photoluminescence dans le cas des lanthanides
II.2.1.a Généralités
II.2.1.b Amélioration des propriétés
II.2.2 Effets des spins électroniques
II.2.3 Cas d’un environnement anionique mixte
III. L’oxyde de Zinc (ZnO)
III.1 Structures
III.2 Dopage du ZnO par des terres rares
III.3 Autres applications du ZnO
IV. Le système calcium-fer-oxygène/soufre
V. Objectifs de cette thèse
Chapitre II – Techniques expérimentales
I. Préparation des échantillons
I.1 Elaboration des films minces
I.1.1 La pulvérisation cathodique magnétron
I.1.2 Films minces d’oxyde de zinc dopés aux terres rares déposés sur silicium
I.1.2.a Substrat de Silicium
I.1.2.b Films minces d’oxyde de zinc dopé à l’erbium, au terbium et/ou europium
I.1.3 Recuits post-synthèse des films d’oxyde de zinc dopé
I.2 Préparation du composé Ca4Fe5S4O6
I.2.1 Elaboration des poudres
I.2.2 Elaboration de monocristaux
I.3 Préparation des échantillons pour les observations en MET
I.3.1 Sections transverses de films minces
I.3.2 Grilles de poudres
II. Techniques d’analyses structurales
II.1 Microscopie Electronique en Transmission
II.1.1 Principe de la microscopie électronique en transmission
II.1.2 La diffraction électronique
II.1.2.a Principe de la diffraction électronique
II.1.2.b Précession électronique et Diffraction Electronique 3D (3D-ED)
II.1.2.c Résolution de structure par 3D-ED
II.2 Microscopie Electronique en Transmission à Balayage
II.2.1 L’imagerie à l’échelle atomique et contraste chimique
II.2.2 Simulation d’imagerie STEM-HAADF
II.3 Méthodes de spectroscopie
II.3.1 La spectroscopie de rayons X à dispersion d’énergie
II.3.2 La spectroscopie des pertes d’énergie des électrons
II.4 La diffraction des rayons X
II.4.1 La diffraction des rayons X sur poudre
II.4.2 La diffraction des rayons X sur monocristal
III. Mesures des propriétés physiques
III.1 Spectroscopie de photoluminescence
III.2 Mesures des propriétés magnétiques
Chapitre III – Etude des films d’Oxyde de Zinc dopé terres rares
I. Cas des films de ZnO avec dopage simple (Eu, Tb ou Er)
I.1 Evolution de la morphologie générale des films avec la température (jusqu’à 700°C)
I.2 Films de ZnO dopé terbium (ZnO:Tb)
I.2.1 Structure et microstructure des films recuits à 1100°C
I.2.2 Recuit à 1200°C
I.3 Films de ZnO dopé europium (ZnO:Eu)
I.3.1 Structure et microstructure des films recuits à 1100°C
I.3.1.a Aspect général
I.3.1.b Analyse de la structure des inclusions formées
I.3.2 Recuit à 1200°C
II. Etude par MET des films de ZnO codopé Tb/Eu
II.1 Etude de la morphologie générale des films
II.2 Etude structurale des inclusions
II.2.1 Inclusions de 900°C à 1100°C : formation d’une structure oxyapatite
II.2.1.a La composition
II.2.1.b Résolution de structure par 3D-ED et imagerie STEM-HAADF
II.2.1.c Étude des états d’oxydation : bond valence et spectroscopie EELS
II.2.1.d Etude d’une possible mise en ordre préférentielle des lanthanides par spectroscopie
II.2.2 Inclusions à 1200°C : mélange structure oxyapatite/disilicate
II.2.2.a La composition
II.2.2.b Résolution de structure par PEDT et imagerie des inclusions riches en TR
II.2.2.c Validation du modèle atomique du disilicate de terres rares (Eu,Tb)2Si2O7 par imagerie STEM-HAADF
II.2.2.d Etude d’une possible mise en ordre préférentielle par spectroscopie
III. Films de ZnO dopé erbium (ZnO:Er)
III.1 Aspect général des films recuits
III.2 Résolution de la structure des inclusions
IV. Relations structure-propriété
IV.1 Etude des distances interatomiques
IV.1.1 Cas du dopage au terbium
IV.1.2 Cas du dopage à l’europium
IV.1.3 Cas du codopage à l’europium et au terbium
IV.1.4 Cas du dopage à l’erbium
IV.2 Etude de la symétrie des sites et de la structure
V. Conclusions et perspectives
Chapitre IV – Etude du composé à matrice oxysulfure : Ca4Fe5S4O6
Conclusion générale