Télécharger le fichier pdf d’un mémoire de fin d’études
L’essor des biotechnologies
Généralités sur l’ADN
En 1869, le biologiste Friedrich Miescher isole une substance riche en phosphore provenant du noyau de globules blancs, qu’il appellera alors « nucléine ». La structure en double hélice de l’acide désoxyribonucléique (ADN) sera décrite presque un siècle plus tard, en 1953, par James Watson et Francis Crick dans la revue Nature grâce aux clichés obtenus par diffraction des rayons X sur des cristaux d’ADN résultant des travaux de Rosalind Franklin et Maurice Wilkins [1]. Ces découvertes majeures ont entrainé une véritable révolution dans la recherche en biologie moléculaire.
L’ADN, présent dans les noyaux des cellules eucaryotes (et en moindre quantité dans la matrice des mitochondries et les chloroplastes des cellules végétales), le cytoplasme des cellules procaryotes ou encore dans les capsides des virus, est principalement connu pour être le porteur de l’information génétique de tous les êtres vivants.
L’ADN est un biopolymère naturel possédant une structure en double hélice. Une hélice (ou brin) est composée d’unités de répétition appelées nucléotides. La structure en double hélice de l’ADN et l’appariement entre les nucléotides sont présentés en Figure I-5. Chaque nucléotide est constitué d’un groupe phosphate chargé négativement, d’un sucre (pentose) et d’une base nucléique. Quatre bases nucléiques constituent l’ADN : l’adénine, la thymine, la cytosine et la guanine (respectivement A, T, C et G). Les nucléotides d’un simple brin d’ADN sont reliés entre eux par des liaisons covalentes entre les groupements phosphates et les désoxyriboses (Figure I-5, b).
La double hélice d’ADN est constituée de deux brins complémentaires et antiparallèles. Deux brins d’ADN possédant des séquences de nucléotides complémentaires peuvent s’apparier deux à deux suivant les règles de Chargaff qui stipulent que dans une molécule d’ADN double brin, la quantité de guanine doit être égale à la quantité de cytosine et que la quantité de thymine doit être égale à la quantité d’adénine. Ainsi, deux brins d’ADN ayant une séquence complémentaire vont s’apparier spontanément pour former la double hélice d’ADN suivant le principe de complémentarité de Watson-Crick. Les bases A et T s’associent via deux liaisons hydrogène, les bases C et G s’apparient via trois liaisons hydrogène. L’extérieur du double brin d’ADN, formé par les groupements phosphates, est hydrophile. Les bases, situées à l’intérieur de la double hélice sont hydrophobes.
Deux types de forces permettent la stabilisation de la double hélice d’ADN [21] :
Les interactions d’appariement grâce aux liaisons hydrogènes entre les bases ;
Les interactions d’empilement intervenant entre les cycles aromatiques des bases (π – stacking). L’assemblage des brins d’ADN est un phénomène réversible. Une augmentation de la température, du pH ou de la force ionique, provoque la rupture des liaisons hydrogènes, entraînant la dénaturation de l’ADN. Lorsque le nombre de bases est compris entre 5 et 50 bases, on parle d’oligonucléotide. Lorsque ce dernier est supérieur à 50 bases, on parle de polynucléotide. Figure I-5 : a) Représentation de la double hélice B d’ADN ; b) Représentation schématique d’un fragment d’ADN constitué de quatre nucléotides, chacun formé d’un groupe phosphate, d’un désoxyribose et d’une base. L’adénine est appariée à la thymine via deux liaisons hydrogène. La guanine est appariée à la cytosine par trois liaisons hydrogène.
Il existe plusieurs conformations de la double hélice d’ADN. Les conformations A, B et Z sont les plus connues à ce jour, et dépendent notamment des séquences de nucléotides, de la force ionique et du degré d’hydratation. Nous nous intéresserons ici uniquement à l’hélice d’ADN-B, qui est la conformation utilisée majoritairement en nanotechnologies à ADN et la forme la plus courante de la double hélice.
L’ADN-B possède une structure en hélice droite d’un diamètre de 2 nm. Le pas de l’hélice est de 3,4 nm avec 10,5 paires de bases par pas, chaque paire de base étant séparée des autres de 0,3 nm (Figure I-5, a).
L’ADN est considéré comme un polymère semi-rigide. Sa longueur de persistance, caractérisant la rigidité intrinsèque d’un polymère, varie en fonction de la concentration en sels dans la solution (monovalents ou multivalents) et de sa conformation (simple ou double brin). La longueur de persistance de l’ADN double brin est de 150 paires de bases, ce qui correspond à 45 nm environ [22]. En d’autres termes, la molécule d’ADN est flexible pour une longueur supérieure à 45 nm et est considérée comme rigide pour des longueurs inférieures. Cette valeur étant supérieure à la distance entre deux jonctions, les origamis d’ADN sont considérés comme des structures rigides [23].
Les avancées majeures en génomique, notamment les différents projets de séquençage de génomes des êtres vivants [24], ont permis le développement de nouvelles technologies en biologie et chimie moléculaire, notamment pour l’extraction, le séquençage et la synthèse d’ADN. L’ADN présente également l’avantage de pouvoir être facilement fonctionnalisé par le greffage de groupements chimiques (par exemple avec des fonctions thiol [25]) ou biologiques (biotine [26]). De plus en plus de recherches utilisent les propriétés de reconnaissance moléculaire unique de l’ADN afin de programmer son auto-assemblage en nanostructures à ADN avec des formes bien précises, permettant d’utiliser l’ADN pour d’autres fonctions que son rôle de porteur de l’information génétique.
Emergence et développement des nanotechnologies à ADN
L’auto-assemblage est le phénomène par lequel des molécules forment par elles-mêmes un système organisé. Ce phénomène se retrouve dans la nature à toutes les échelles, aussi bien à l’échelle moléculaire qu’à l’échelle de l’univers, permettant la formation de systèmes extrêmement complexes.
Les nanotechnologies à ADN utilisent les propriétés d’auto-assemblage de l’ADN afin de créer des structures artificielles à objectif technologique et à l’échelle nanométrique.
A Naissance des nanotechnologies ADN
C’est en 1982 que Nadrian Seeman, pionnier des nanotechnologies à ADN, a l’idée d’utiliser les propriétés d’auto-assemblage de l’ADN pour créer des nanostructures en ADN en deux ou trois dimensions [27] basés sur ses précédents travaux portant sur les jonctions de Holliday.
Une jonction de Holliday est une structure à quatre hélices d’ADN, naturellement présente et intervenant lors du processus de recombinaison génétique chez les êtres vivants. L’idée de Seeman était d’assembler entre elles des jonctions Holliday possédant des extrémités cohésives (c’est-à-dire des extrémités d’ADN non hybridées) afin de créer des mailles périodiques en deux dimensions, comme illustré sur la Figure I-6. Cependant, les premières structures en 2D n’ont été réalisées qu’en 1998 [28].
Développement des origamis d’ADN
Les origamis à ADN ont été imaginés et créés par Paul Rothemund en 2006 [29]. Cette technique repose sur les propriétés de reconnaissance moléculaire de l’ADN lui permettant de s’auto-organiser en structures spécifiques.
Un origami est basé sur le repliement d’un long brin d’ADN (généralement bactérien) par l’intermédiaire de petits brins complémentaires appelés agrafes. L’ADN le plus utilisé dans la littérature pour élaborer les origamis est un ADN circulaire simple brin (le M13mp18, issu d’un bactériophage) constitué de 7249 bases. Ce dernier est ouvert à l’aide d’une enzyme de restriction afin d’obtenir un brin d’ADN linéaire. Environ 200 agrafes – des oligonucléotides synthétiques – de quelques dizaines de nucléotides sont ensuite ajoutées afin de replier le brin d’ADN et ainsi obtenir la forme souhaitée après chauffage, comme illustré sur la Figure I-7. En fonction du choix des agrafes et de leur position sur le brin principal, une infinité de forme peuvent ainsi être réalisées, de l’étoile au triangle, mais la plus connue reste le célèbre « smiley » de Rothemund en ADN. Conception des origamis d’ADN. Dans un premier temps, un schéma de la structure souhaitée est défini sur un logiciel dédié. Le plus couramment utilisé est le logiciel caDNAno [30]. Le logiciel va déterminer les séquences et le placement des agrafes de manière à replier le brin d’ADN pour obtenir la forme souhaitée.
Synthèse des origamis d’ADN. Lorsque la structure, le choix des séquences d’oligonucléotides et leur position sur le brin d’ADN sont déterminés, l’étape de synthèse des origamis d’ADN peut avoir lieu. Le brin principal est mélangé avec les agrafes présentes en large excès dans un équipement de PCR (Réaction en Chaîne par Polymérase). Le mélange est dans un premier temps chauffé entre 65°C et 90°C afin de déshybrider l’ADN, puis la température est progressivement diminuée jusqu’à température ambiante afin de permettre l’appariement du brin d’ADN avec les oligonucléotides. La synthèse s’effectue en solution tampon en présence de sels de magnésium (Mg2+) afin de compenser les répulsions électrostatiques entre les agrafes et le brin principal dues aux charges négatives des groupes phosphates de l’ADN.
Purification des origamis d’ADN. Une étape de purification des origamis d’ADN est généralement réalisée après l’étape de synthèse afin d’éliminer les oligonucléotides présents en large excès dans la solution, ces derniers pouvant avoir une influence lors de l’utilisation ultérieure des origamis. La méthode de purification la plus utilisée est l’électrophorèse sur gel d’agarose, qui permet de séparer des molécules en fonction de leur taille. Ainsi, les fragments de plus petite taille migreront plus rapidement que les fragments de plus grande taille, permettant de séparer les nanostructures synthétisées des oligonucléotides en excès.
Cependant, cette technique peut déstructurer certains origamis. Une autre technique de purification des origamis d’ADN est la centrifugation, qui consiste à séparer par gradient de densité les nanostructures des oligonucléotides [31].
4- Caractérisation des origamis d’ADN. Afin de s’assurer du bon repliement des structures, différentes techniques de caractérisation peuvent être utilisées. L’électrophorèse sur gel d’agarose permet de vérifier le poids moléculaire des structures et donc le bon repliement de ces dernières. La microscopie électronique à transmission (TEM) ou l’AFM (Microscopie à Force Atomique) sont des techniques permettant d’observer directement les origamis d’ADN synthétisés.
Le rendement moyen de synthèse des origamis est de 90%, ce qui est relativement élevé étant donné la quantité d’oligonucléotides présents dans un origami (~200) [29] .
Rapidement après leur introduction par Paul Rothemund en 2006, des structures en 2D et en 3D de plus en plus complexes à l’échelle nanométrique sont développées [32], [33], [34], [35]. Ainsi, en 2009, Shawn Douglas élabore un origami d’ADN « multicouches » en 3D, obtenu par repliement d’une seule couche d’origami avec des agrafes. Le principe et des images MET d’exemples de structures ainsi obtenues sont illustrés sur la Figure I-8 [32]. Les structures d’origami 3D permettent d’élargir les applications potentielles, en offrant plus de possibilités structurelles, et la capacité d’encapsuler des molécules telles que des protéines, des enzymes ou encore des nanoparticules [36]. Une équipe danoise démontre en 2009 qu’il est possible de former un cube avec un couvercle programmable en auto-assemblant six structures planes d’origamis par les côtés afin d’obtenir des nanostructures 3D [34]. Ce cube possède la particularité d’avoir un couvercle pouvant s’ouvrir ou se fermer en ajoutant des oligonucléotides spécifiques en solution, avec des perspectives possibles pour la délivrance de molécules biologiques par exemple.
Cependant la technique des origamis d’ADN ne permet pas de synthétiser des objets de taille supérieure à l’ordre de la centaine de nanomètres, pouvant limiter leur utilisation pour certaines applications ultérieures.
Pour y remédier, une solution est de connecter plusieurs origamis entre eux en greffant des oligonucléotides complémentaires (extrémités cohésives) les uns avec les autres afin de créer des
« tapis 2D » ordonnés à longue distance (de l’ordre du micromètre carré) [37], [38]. L’équipe de
Yonggang Ke a ainsi auto-assemblé des origamis de forme hexagonale grâce à des interconnections, permettant d’obtenir des tapis 2D ou des tubes organisés sur des surfaces de l’ordre du micromètre carré. Ces nanostructures ont été combinées avec des nanoparticules d’or, résultant en l’obtention des réseaux ordonnés de nanoparticules d’or, comme présenté sur la Figure I-9, a [39]. Des « superstructures » 3D d’origamis d’ADN peuvent être obtenues en utilisant le même principe : des chercheurs ont programmé 30 000 fragments d’ADN, appelés « briques », pour qu’ils s’encastrent les uns aux autres à la manière des briques de Lego® en une forme désirée. Les structures peuvent ainsi être modulées en retirant certaines de ces briques. Dans le cas de la Figure I-9, b, un ourson en 3D est ainsi obtenu avec cette technique [33].
Figure I-9 : a. Schémas des différents auto-assemblages des monomères hexagones avec des nanoparticules d’or en tapis 2D ou en tubes, et images MET correspondantes [39]. b. Principe de l’auto-assemblage de nanostructures d’ADN en 3D obtenues à partir de briques d’ADN [33].
Applications des origamis d’ADN
Le développement des origamis d’ADN et leur fonctionnalisation (nanoparticules, enzymes, groupements chimiques) a entraîné la création de structures de plus en plus complexes, permettant d’explorer un champ des possibles extraordinaire dans de nombreux domaines d’applications. Ainsi, les nanotechnologies à ADN peuvent être utilisées dans des domaines aussi variés que la nano-médecine, la nano-robotique ou la plasmonique [40], [41], [42]. Avant de présenter plus spécifiquement l’utilisation des origamis d’ADN pour la microélectronique, nous allons introduire plus généralement les applications déjà existantes ci-après.
Origamis d’ADN pour des applications biologiques
Un des champ d’application le plus prometteur des origamis d’ADN est le domaine biomédical [43], [44], [45]. Des équipes ont démontré que les origamis d’ADN pouvaient être utilisés pour la délivrance de médicaments in-vivo [46], permettant de cibler spécifiquement des cellules tumorales via le greffage d’un anti-tumoral, la doxorubicine (DOX) dans ce cas, sur des origamis d’ADN, comme illustré sur la Figure I-10. a. La molécule anticancéreuse est intercalée de façon non covalente dans les structures des origamis d’ADN, avant d’être injectés par voie intra-veineuse in-vivo. L’accumulation et la digestion du système origamis d’ADN/DOX dans la zone d’intérêt (ici la mamelle) sont ensuite analysées. Cette étude a montré qu’en plus d’être non toxiques pour l’organisme, les origamis d’ADN combinés à l’anticancéreux étaient plus efficaces contre la tumeur que l’injection seule de l’anti-tumoral, puisque ces derniers vont s’accumuler et se dégrader au sein de la tumeur sur des temps plus longs.
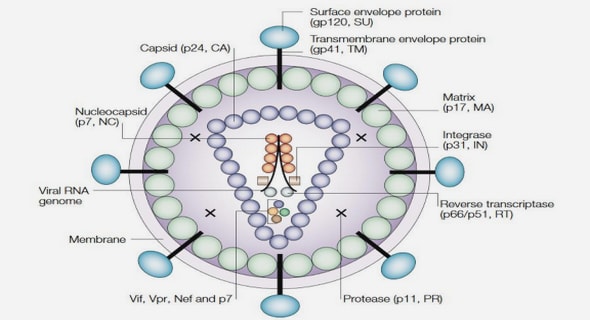
Figure I-10 : a. Représentation schématique de l’élaboration des origamis d’ADN et de leur couplage avec l’anti-tumoral. b. Injection des complexes origamis d’ADN/anti-tumoral chez la souris par voie sanguine, puis accumulation et dégradation de ces complexes au sein de la tumeur [46]. En 2020, une équipe américaine a utilisé des origamis d’ADN pour mimer la structure du virus du sida, et y a greffé des antigènes capables d’activer le système immunitaire [47]. Les cellules immunitaires (globules blancs) vont conserver cette mémoire immunitaire de l’antigène afin de réagir en cas de réinfection. Cette technique pourrait servir pour d’autres virus, notamment celui de la Covid-19.
Au-delà de leur utilisation pour le biomédical, les origamis d’ADN peuvent servir de support réactionnel pour des réactions biologiques telles que la catalyse [48] ou encore des réactions enzymatiques [49], [50] et être utilisés pour les bio-capteurs [51].
Des origamis d’ADN capables de changer de conformation en fonction du pH ont également été développés [52], permettant ainsi de détecter des variation de pH à l’échelle microscopique (dans les cellules par exemple).
Origamis d’ADN pour l’auto-assemblage de nano-objets
Les origamis d’ADN peuvent être utilisés pour le positionnement précis de nano-objets tels que des nanoparticules d’or [53], [54], [55], des nanoparticules métalliques, des quantum dots ou des nanotubes de carbone [56], permettant leur arrangement à l’échelle nanométrique avec des applications possibles en plasmonique ou en photonique [57] .
Des protéines ont également été immobilisées sur la surface d’origamis d’ADN, afin de réaliser par exemple de des études structurales de ces dernières et ainsi mieux appréhender la compréhension des mécanismes moléculaires se déroulant à la membrane cellulaire [58], [59].
Utilisation d’ADN pour la microélectronique
De par leur structuration nanométrique et leurs propriétés d’auto-assemblage, les nanostructures d’ADN sont des candidats idéaux pour la microélectronique :
Réalisation d’interconnections à partir d’ADN : De nombreuses études ont été réalisées sur la métallisation de nanofils d’ADN, avec pour objectif la création d’interconnections pouvant atteindre un diamètre théorique de 2 nm dans des dispositifs microélectroniques toujours plus petits [60], [61],
[62]. La Figure I-11 représente les images MEB obtenues par Christophe Brun et al. de nanofils d’ADN suspendus sur des électrodes de photorésines (a) et de SiO2 (b) avec des diamètres compris entre 20 nm et 50 nm [62] .
Dopage localisé à partir d’ADN : Dans une récente étude, de l’ADN a été utilisé pour réaliser le dopage de type-n d’un substrat de silicium [63]. L’ADN sert ici à la fois de source de dopant grâce aux groupes phosphates qui le composent naturellement, et de masque de par sa forme. Des prototypes de transistors à effets de champ dopés par cette technique ont permis de confirmer le dopage du substrat de silicium à partir de nanotubes d’ADN.
Patterning à partir d’origamis d’ADN : L’utilisation de nanostructures d’ADN comme masques pour la lithographie est l’application ciblée pour cette thèse et sera plus approfondie dans la troisième partie de ce chapitre.
Les nanotechnologies à ADN sont-elles économiquement viables pour une utilisation industrielle ?
Si les nanotechnologies à ADN offrent des perspectives exceptionnelles en termes de recherches et d’applications, différentes questions peuvent subsister sur les limites de ces technologies, notamment sur leur coût de production.
Rob Carlson, spécialisé dans l’analyse de l’économie des biotechnologies, a estimé le coût de synthèse par base pour des oligonucléotides et des gènes au cours des années (Figure I-12). Le prix en 2014 pour la synthèse des oligonucléotides était estimé à environ 0,10 euros par base [64]. Le coût total de l’utilisation d’origamis d’ADN est quant à lui estimé entre 6 et 10 $/m2 [65], [66].
Généralités sur la stabilité des origamis d’ADN
Comme rapporté précédemment, les origamis d’ADN présentent un large champ d’applications au cours desquelles les structures seront fréquemment exposées à des environnements physiques et chimiques extrêmes (pH, température, sels ou bombardements ioniques par exemple). Plusieurs études se sont donc intéressées à la stabilité des origamis d’ADN dans divers environnements. L’ADN est un polymère chargé négativement grâce aux groupements phosphate situés à l’extérieur du brin, ce qui lui confère des propriétés hydrophiles (l’intérieur du brin est quant à lui hydrophobe). Des cations (par exemple des ions Mg2+ ou Na+) sont nécessaires pour neutraliser les charges négatives des brins d’ADN et donc stabiliser la structure en limitant la répulsion entre les brins.
Charlotte Kielar a étudié l’influence de la composition de la solution tampon sur la stabilité des origamis d’ADN [71]. L’étude démontre que la présence d’EDTA (Éthylènediaminetétraacétique) pouvait complexer les ions Mg2+, réduisant la force des interactions Mg2+-ADN, ce qui va déstabiliser et dénaturer l’origami d’ADN. L’utilisation d’ions Na+ dans la solution tampon serait dix fois moins efficace pour stabiliser ADN que Mg2+ [72]. Enfin, la composition de la solution tampon n’aura pas la même influence sur la stabilité des structures en fonction de leur taille et de leur forme respectives, puisqu’elle n’équilibrera pas les charges de manière équivalente [73].
Interactions entre origamis d’ADN et substrats
Les études réalisées au cours de cette thèse impliquent de déposer les origamis d’ADN sur un substrat. C’est pourquoi nous allons nous intéresser ici à la stabilité des nanostructures d’ADN adsorbées sur des surfaces, et plus particulièrement sur des surfaces de SiO2 qui ont été majoritairement utilisées au cours de la thèse.
De par ses propriétés hydrophiles présentées précédemment, l’ADN va interagir préférentiellement avec des surfaces hydrophiles ou chargées positivement. Les origamis d’ADN sont adsorbés sur SiO2 via des interactions électrostatiques intervenant entre l’ADN chargé négativement, les ions Mg2+ servant de contre-ion médiateur et les groupements hydroxyles de surface chargés négativement [74]. Cependant, à de trop grandes concentrations en Mg2+ (supérieure à 1 mol/L) une inversion de charge peut se produire au niveau des structures d’ADN, et entraîner une répulsion entre la surface de SiO2 et les nanostructures [75], [76]. Le pH joue également un rôle important pour l’adsorption des origamis d’ADN sur la surface. Travailler à des pH autour de 8-9 permet d’augmenter la densité de charges négatives à la surface du SiO2 [77] et donc de favoriser l’adsorption des nanostructures d’ADN.
Kim et al. se sont intéressés à la stabilité des origamis d’ADN adsorbés sur SiO2 soumis à différents environnements chimiques susceptibles d’impacter les structures utilisées pour nos études (traitements thermiques, immersion dans des solvants, traitements UV/O3) [78]. Les origamis d’ADN se sont montrés résistants à des conditions d’expérimentation parfois extrêmes. La Figure I-14 présente les images AFM d’origamis d’ADN adsorbés sur SiO2 et soumis à différentes conditions environnementales (pH, UV/O3 et température) :
Stabilité thermique des origamis d’ADN (Figure I-14, C) : en solution, la stabilité de l’ADN est limitée par la déshybridation du double brin. Cette température dépend de la séquence du double brin et de la composition du tampon, mais est généralement comprise entre 40°C et 100°C [79]. Cependant, une fois déposé sur un substrat solide et chauffé à sec, la nanostructure d’ADN peut conserver sa forme à des températures bien plus élevées car les brins sont immobilisés à la surface. Aio et al. [80] ont réalisé des analyses thermogravimétriques (TGA) sur de l’ADN de saumon, sous atmosphère d’azote. Une décomposition de l’ADN a été observée à 230°C, et à 500°C, 53% de la masse était conservée. Afin de déterminer si les origamis adsorbés sur SiO2, conservent leur forme lorsqu’ils sont soumis à un stress thermique, Kim et al. ont chauffé les origamis à différentes températures, sous atmosphère d’air ou d’azote durant 10 min. Il s’avère que la forme n’est pas altérée jusqu’à 300°C pour les deux atmosphères. Cependant, à partir de 200°C, il est observé une diminution de la hauteur des structures qui semblent se décomposer. Il est supposé qu’après une thermalisation à 200°C, seuls les résidus inorganiques de l’ADN demeurent. Aucune influence de l’atmosphère n’a été identifiée, ce qui signifie que la dégradation de l’ADN n’implique pas d’oxydation.
Effets des solvants de rinçage : Un des risques lors de l’étape de rinçage des origamis est leur désorption du substrat. Dans leur étude, Kim et al. ont étudié la stabilité d’origamis d’ADN adsorbés sur SiO2 puis rincés dans divers solvants [78].
Solvants organiques (hexane, éthanol, toluène) : Différents types de solvants organiques, polaires et non polaires ont été étudiés. Après 24h d’immersion dans les différents solvants organiques, la densité, la taille et la forme des nanostructures adsorbées sur SiO2 sont similaires à celles observées avant l’immersion. Ces derniers ne semblent donc pas avoir d’influence sur la stabilité des origamis.
Influence d’un rinçage à l’EDI (Eau Déionisée) : Un rinçage à l’EDI semble diminuer la densité d’origamis présents à la surface du substrat et ce, dès 10 s d’immersion. La structure des origamis semble également endommagée. Les auteurs ont par ailleurs noté que les résultats ne sont pas reproductibles d’une expérience à l’autre.
Effet du pH (Figure I-14, A) : Des pH inférieurs à 4 dénaturent les origamis d’ADN en plusieurs parties. Leur intégrité structurelle est bien préservée jusqu’à pH 11. A partir de pH 12, la forme n’est pas altérée mais le motif est difficile à caractériser. D’après les auteurs, l’ADN s’est probablement déshybridé et hydrolysé. Il est connu que l’hydrolyse des brins d’ADN se produit à trois endroits différents du brin d’ADN : au niveau des groupements phosphodiesters, des bases d’ADN et des liaisons glycosidiques.
Effet de l’oxydation par UV/O3 (Figure I-14, B) : les UV/O3 sont communément utilisés pour éliminer des composants organiques en surface, et pour nettoyer les surfaces. Après 5 min d’exposition aux UV/O3, la structure des origamis d’ADN est intacte. Après 15 min d’exposition, la hauteur des origamis diminue de 45% mais étonnement, la forme ne semble pas endommagée. Ce cas de figure est similaire à celui observé lors des traitements thermiques. De la même manière, cette observation est attribuée aux résidus inorganiques de la décomposition d’ADN.
Pour résumer sur les différents facteurs pouvant influencer la stabilité des nanostructures d’ADN : (1) Traitements thermiques : les origamis sont stables jusqu’à 200°C. Au-delà, les nanostructures se décomposent mais les parties inorganiques de l’ADN permettent de conserver la forme globale du motif de la structure. (2) Rinçages par solvants organiques : Les origamis sont stables dans des solvants organiques pendant au moins 24h. (3) Rinçage dans l’EDI : Les nanostructures d’ADN se désorbent de la surface. (4) pH : Les origamis sont stables dans une gamme de pH comprise entre 7 et 11. En dehors de cette gamme, les origamis sont instables et se dégradent. (5) Les origamis résistent pendant 5 min aux UV/O3.
|
Table des matières
LISTE DES PERSONNES AYANT EFFECTUE DES EXPERIENCES OU DES ANALYSES
CHAPITRE I- LES NANOTECHNOLOGIES A ADN PEUVENT-ELLES ETRE UNE SOLUTION AUX DEFIS DE LA MICROELECTRONIQUE ?
I.1 LES ENJEUX DE LA MICROELECTRONIQUE
I.1.1 Historique et enjeux
I.1.2 Limites des techniques de lithographie conventionnelle
I.1.3 Développement et essor des lithographies alternatives
I.1.4 La gravure
I.2 L’ESSOR DES BIOTECHNOLOGIES
I.2.1 Généralités sur l’ADN
I.2.2 Emergence et développement des nanotechnologies à ADN
I.2.3 Interactions et stabilité physico-chimiques des origamis d’ADN
I.3 NANOSTRUCTURATION DE SURFACES PAR ORIGAMIS D’ADN
I.3.1 Pourquoi l’ADN pour la lithographie ?
I.3.2 Transfert de motifs d’origamis d’ADN
I.3.3 Problématique du positionnement de nanostructures d’ADN sur un substrat
I.4 MOTIVATIONS ET OBJECTIFS DE LA THESE
CHAPITRE II- MATERIEL ET METHODES
II.1 PROTOCOLE EXPERIMENTAL DE DEPOT DE NANOSTRUCTURES D’ADN SUR SUBSTRATS
II.1.1 Choix et description des nanostructures d’ADN utilisées
II.1.2 Protocole de dépôt des origamis d’ADN
II.2 METHODES DE CARACTERISATIONS D’ORIGAMIS D’ADN ET DES MOTIFS ISSUS DES PROCEDES LITHOGRAPHIQUES
II.2.1 Caractérisations morphologiques
II.2.2 Caractérisations physico-chimiques
CHAPITRE III- DEVELOPPEMENT ET OPTIMISATION DE PROCEDES DE TRANSFERT DE NANOSTRUCTURES D’ADN
III.1 TRANSFERT PAR ATOMIC LAYER ETCHING (ALE)
III.1.1 Rappels sur les mécanismes de gravure de SiO2 en plasma fluorocarboné
III.1.2 Mécanismes de gravure par ALE
III.1.3 Protocole expérimental
III.1.4 Etude des paramètres de gravure par ALE sur SiO2
III.1.5 Etude du transfert par ALE d’un masque en origami d’ADN
III.1.6 Bilan et conclusion sur l’ALE
III.2 DEVELOPPEMENT D’UN PROCEDE DE GRAVURE DU SI A PARTIR D’UN MASQUE EN ORIGAMI D’ADN
III.2.1 Introduction
III.2.2 Protocole expérimental
III.2.3 Résultats
III.2.4 Conclusion
III.2.5 Application au transfert de nanostructures auto-assemblées en 2D
III.3 ETUDE DE LA RUGOSITE POST-HF
III.3.1 Introduction
III.3.2 Méthodes expérimentales
III.3.3 Contribution des oligonucléotides sur la rugosité post-HF
III.3.4 Contribution du solvant de rinçage sur la rugosité post-HF
III.3.5 Conclusion
III.4 CONCLUSION GENERALE DU CHAPITRE
CHAPITRE IV- POSITIONNEMENT D’ORIGAMIS D’ADN SUR UNE SURFACE STRUCTUREE
IV.1 INTRODUCTION ET STRATEGIE MISE EN PLACE
IV.1.1 Introduction
IV.1.2 Présentation du procédé
IV.1.3 Affinité des origamis d’ADN sur les substrats
IV.2 PRE-STRUCTURATION DE SURFACE PAR LITHOGRAPHIE
IV.2.1 Le cas particulier de la lithographie par nano-impression (NIL)
IV.2.2 Définition des motifs de positionnement par lithographie électronique
IV.2.3 Définition des motifs de positionnement par lithographie 193i
IV.3 ACTIVATION DES SITES D’ACCROCHE
IV.4 RETRAIT DE LA RESINE
IV.5 CARACTERISATIONS PHYSICO-CHIMIQUES DU PROCEDE
IV.5.1 Mesures d’angles de contact de l’eau
IV.5.2 Caractérisations FTIR-MIR
IV.6 ESSAIS DE POSITIONNEMENT D’ORIGAMIS D’ADN SUR UNE SURFACE PRE STRUCTUREE
IV.6.1 Protocole expérimental
IV.6.2 Résultats
IV.6.3 Conclusion et perspectives
CHAPITRE V- DEPOT D’ORIGAMIS D’ADN SUR SUBSTRATS IMPLANTES
V.1 INTRODUCTION
V.1.1 Principe de l’implantation ionique
V.1.2 Application au positionnement d’origamis d’ADN
V.2 PROTOCOLE EXPERIMENTAL
V.2.1 Implantation ionique et recuit sur pleine plaque
V.2.2 Procédé d’implantation ionique sur plaques structurées
V.3 RESULTATS ET CARACTERISATIONS
V.3.1 Dépôt d’origamis d’ADN sur plaques implantées
V.3.2 Caractérisation du procédé d’implantation ionique
V.3.3 Etudes des interactions ADN / substrat
V.4 CONCLUSION ET PERSPECTIVES
CONCLUSION GENERALE ET PERSPECTIVES
CONCLUSION GENERALE
PERSPECTIVES
I. Transfert des motifs dans le silicium
II. Perspectives autour du positionnement déterministe
BIBLIOGRAPHIE
Télécharger le rapport complet