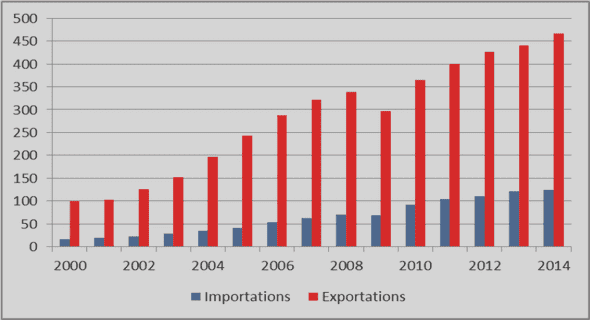
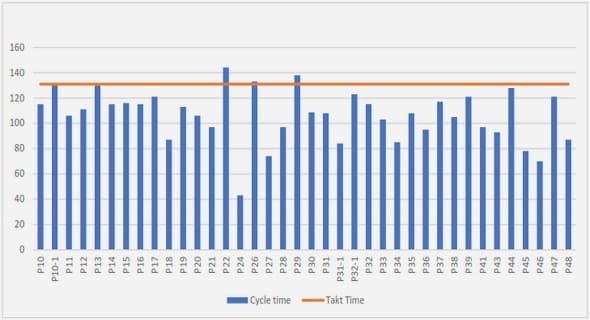
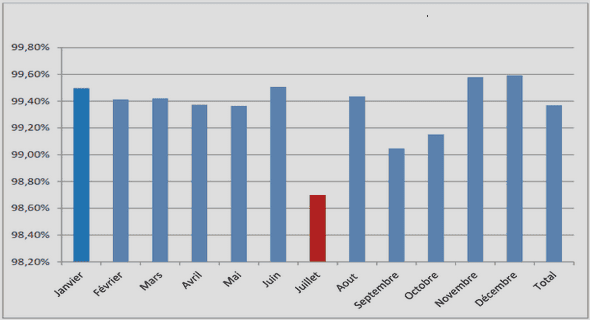
Télécharger le fichier pdf d’un mémoire de fin d’études
Fruits
Répartition géographique
Pharmacologie
Toute attaque radicalaire d’un acide aminé provoquera l’oxydation de certains résidus avec pour conséquences, l’apparition de groupements carbonylés (Yuichiro J & al., 2010), des clivages de chaînes peptidiques et des ponts bi-tyrosine intra et inter-chaînes. La plupart des dommages sont irréparables et peuvent entraîner des modifications fonctionnelles importantes (non-reconnaissance d’un récepteur par un ligand, perte d’activité enzymatique). Certaines protéines oxydées sont peu dégradées et forment des agrégats qui s’accumulent dans les cellules et dans le compartiment extracellulaire.
Le radical lipidique réagit avec une molécule d’oxygène pour former un radical peroxyle (ROO•), suffisamment réactif pour arracher un H+ à un AGPI voisin, régénérer le radical lipidique et propager ainsi la réaction : c’est la phase de propagation R• + O2 ROO• ROO• + RH ROOH + R•
Il en résulte une altération de la fluidité membranaire qui conduit inévitablement à la mort cellulaire.
Les peroxydes générés seront neutralisés par la glutathion peroxydase ou continueront à s’oxyder et à se fragmenter en aldéhydes (malondialdéhyde, 4-hydroxynonénal) dont les activités pro-athérogènes sont bien connues.
On distingue deux sources d’antioxydants :
Une source endogène qui se compose
– d’enzymes (superoxyde dismutase, glutathion peroxydase, catalase) ;
– de protéines (ferritine, transferrine, céruléoplasmine, albumine) ;
– de systèmes de réparation des dommages oxydatifs comme les endonucléases ;
– des oligoéléments comme le sélénium, le cuivre et le zinc qui sont des cofacteurs d’enzymes antioxydantes.
Une source exogène apportée par l’alimentation sous forme de fruits et légumes riches en vitamines C, E, caroténoïdes, ubiquinone, flavonoïdes, glutathion ou acide lipoïque.
Ce sont des métalloprotéines qui représentent une des premières lignes de défense contre le stress oxydant, assurent l’élimination de l’anion superoxyde O2•- par une réaction de dismutation, en le transformant en peroxyde d’hydrogène (moins toxique) et en oxygène selon la réaction suivante : 2O2 – +2H+ SOD H2O2 + O2
Le peroxyde d’hydrogène formé est pris en charge par la catalase et les glutathion peroxydases.
Chez l’homme, on décrit 3 isoenzymes :
Une SOD à cuivre et à zinc (Cu/Zn-SOD), intracellulaire, située dans le cytoplasme et dans l’espace intermembranaire des mitochondries ; elle remplit une action antioxydante importante dans l’espace intermédiaire mitochondrial où il y a une accumulation importante de protons.
Une autre SOD à cuivre et à zinc est extracellulaire principalement dans la matrice extracellulaire des tissus et à un degré moindre dans les liquides extracellulaires des tissus (plasma, lymphe) ; elle joue un rôle important dans la protection des surfaces cellulaires et des protéines de la matrice
extracellulaire contre l’action des O2 .
Une SOD à manganèse (Mn-SOD) qui est située à la fois dans la matrice et au niveau de la membrane interne de la mitochondrie (Ango Gueboté, 2016).
La catalase
Elle complète l’action des SOD en accélérant la réduction spontanée du peroxyde d’hydrogène en eau et en oxygène moléculaire selon la réaction suivante : 2H2O2 Catalase 2H2O+O2
Les glutathion peroxydases (GPxs)
La GPx est une enzyme séléno-dépendante retrouvée dans le cytoplasme des cellules rénales, hépatiques, sanguines.
Son rôle principal consiste en l’élimination non seulement des peroxydes d’hydrogène mais également des peroxydes lipidiques résultant de l’action du stress oxydant sur les acides gras polyinsaturés.
Il catalyse la réduction des peroxydes en molécule d’eau en présence de glutathion réduit selon la réaction suivante : H2O2 + 2GSH GPx 2H2O + GSSG
Le glutathion est un tripeptide (acide glutamique-cystéine-glycine). Il est le thiol (-SH) majoritaire au niveau intracellulaire (l’albumine étant son équivalent plasmatique) où il est présent sous forme essentiellement réduite (GSH). Dans des conditions physiologiques, sa forme oxydée (GSSG) est en concentration très faible. Le rapport GSH/GSSG est considéré comme un excellent marqueur de la peroxydation lipidique et permet d’objectiver l’importance du stress.
Au cours du vieillissement et lors d’un exercice intense, ce rapport tend à diminuer. Les autres propriétés antioxydantes du GSH sont nombreuses : cofacteur de la GPx, chélateur des métaux de transition, régénérateur final des vitamines E et C, à partir de leur forme radicalaire (Haleng et al, 2007).
Le Coenzyme Q10
Le coenzyme Q10, appelé ubiquinone en raison de son ubiquité dans les cellules, est un dérivé benzoquinolique avec une longue chaîne latérale isoprénique. Cette chaîne latérale confère à la molécule un caractère lipophile qui lui permet de s’insérer dans les membranes et les lipoprotéines. Il joue un rôle essentiel dans la chaîne mitochondriale de transport d’électrons et est un puissant inhibiteur de peroxydation lipidique, en synergie avec la vitamine E.
L’acide urique
Produit terminal majeur du métabolisme des purines chez l’homme, il est à pH physiologique majoritairement ionisé sous forme d’urate, un piégeur puissant de radicaux (OH•, ROO•, NOO• …). Ces réactions conduisent à des espèces radicalaires qui seront à leur tour réduites (notamment par la vitamine C). Les propriétés antioxydantes de l’urate in vivo peuvent être appréciées indirectement par le fait qu’un produit de réaction de l’urate avec les EROs, l’allantoïne, est présent à des taux élevés lors d’un stress oxydant.
La bilirubine
La bilirubine est un produit terminal de la dégradation de l’hème et résulte essentiellement du catabolisme de l’hémoglobine par les cellules réticuloendothéliales. Composé non hydrosoluble, elle se lie à l’albumine dans un rapport stœchiométrique 1/1, ce qui empêche sa pénétration dans des tissus riches en lipides tels que le cerveau. La bilirubine est capable de piéger le radical peroxyde et l’oxygène singulet. Ainsi, elle protège l’albumine et les acides gras liés à l’albumine des attaques radicalaires.
Le sélénium n’est pas un antioxydant en tant que tel, car il ne peut piéger les radicaux libres, mais il joue un rôle primordial comme cofacteur de la GPx. Dans l’alimentation, on retrouvera essentiellement du sélénium organique, lié à un acide aminé, la cystéine. Le sélénium organique est mieux absorbé, il subit une
métabolisation hépatique qui conduit à des intermédiaires nécessaires à la synthèse de dérivés physiologiquement actifs comme la GPx. La dose journalière recommandée est de 50-70 µg/jour. Les aliments riches en sélénium sont, notamment, les noix de Brésil, les brocolis, l’ail…
Le cuivre
A concentration physiologique, le cuivre est le cofacteur d’enzymes comme la SOD, le cytochrome C oxydase, la dopamine β-hydroxylase. Cependant, en tant que métal de transition, il joue un rôle important dans le déclenchement de réactions de production d’EROs (réactions de Fenton) et peut lorsque sa concentration est élevée devenir pro-oxydant.
Le zinc
Le zinc joue un rôle de cofacteur pour de nombreux enzymes et intervient ainsi dans de nombreuses fonctions comme le métabolisme des nucléotides, la synthèse des prostaglandines, le fonctionnement de l’anhydrase carbonique. Comme le cuivre, le zinc est un des cofacteurs essentiels de la SOD. Il protège également les groupements thiols des protéines et il peut inhiber les réactions de formation d’EROs induites par des métaux de transition comme le fer ou le cuivre. Le rapport Cu / Zn, (normalement inférieur à 1,5) sera un excellent indicateur de l’état de stress oxydant d’un individu.
|
Table des matières
INTRODUCTION
PREMIERE PARTIE : RAPPELS BIBLIOGRAPHIQUES RAPPELS SUR CASSIA SIEBERIANA DC
I.1. Etude taxonomique
I.2. Synonymes et appellations
I.3. Description botanique
I.3.1. Port
I.3.2. Feuilles
I.3.3. Inflorescence
I.3.4. Fruits
I.4. Répartition géographique
I.5. Chimie
I.6. Emplois et propriétés pharmacologiques
I.6.1. Emplois
I.6.2. Pharmacologie
I.7. Toxicité
GENERALITES SUR LE STRESS OXYDATIF
II.1. Définitions
II.1.1. Les radicaux libres
II.1.2. Le stress oxydatif
II.2. Mécanisme du stress oxydatif
II.2.1. Origine cellulaire des radicaux libres
II.2.2. Cibles biologiques des radicaux libres
II.3. Mécanismes de détoxification de l’organisme
II.3.1. Sources endogènes d’antioxydants
II.3.2. Sources exogènes d’antioxydants
II.4. Impact du stress oxydant dans les pathologies diverses
II.4.1. Stress oxydant et vieillissement
II.4.2. Stress oxydant et maladie d’Alzheimer
II.4.3. Stress oxydant et maladie de Parkinson
II.4.4. Stress oxydant et diabète
ETUDE DE L’ACTIVITE ANTIRADICALAIRE PAR LA MÉTHODE ABTS
DEUXIEME PARTIE : ETUDE EXPERIMENTALE
MATERIEL ET METHODES
I.1. Matériel et réactifs
I.1.1. Matériel végétal
I.1.2. Matériel de laboratoire
I.1.3. Principaux réactifs utilisés
I.2. Méthodes
I.2.1. Teneur en eau
I.2.2. Extraction et fractionnement
I.2.3. Activité antiradicalaire
RESULTATS
II.1. Teneur en eau
II.2. Rendements d’extraction et de fractionnement
II.3. Activité antiradicalaire
II.3.1. Pourcentages d’inhibition
II.3.2. CI50 des produits testés
DISCUSSION
III.1. Teneur en eau
III.2. Extraction et fractionnement
III.3. Activité antiradicalaire
CONCLUSION ET PERSPECTIVES
REFERENCES BIBLIOGRAPHIQUES
ANNEXES
Télécharger le rapport complet