Historique
La dengue a été décrite dès 1779 au Venezuela. Elle est répandue dans toutes les zones tropicales et subtropicales du monde. Il s’agit de Flavivirus, infectant parfois des singes, mais dont l’hôte vertébré habituel est avant tout l’homme. Le virus de la dengue est transmis par des moustiques du genre Aedes. Quatre sérotypes viraux dénommés « Dengue 1, 2, 3, 4 », en sont responsables. Pendant près de deux siècles, la dengue a été classée comme un incident mineur de l’acclimatation tropicale. Mais, au cours de la seconde guerre mondiale, des épidémies très importantes ont frappé les troupes américaines, mettant cette maladie sur le même plan que le paludisme(3).
Epidémiologie
Très répandue dans les zones tropicales et subtropicales du monde, la dengue constitue aujourd’hui, par ses formes hémorragiques, le plus sérieux problème de santé publique posé par les arboviroses. On peut schématiquement distinguer, à ce propos :
✦ des zones endémiques, où les quatre sérotypes viraux circulent en permanence (endémo-épidémie). Il s’agit essentiellement du Sud-Est asiatique ;
✦ des zones épidémiques, où un type donné de virus se dissémine de proche en proche, grâce aux déplacements des voyageurs. Ce sont : l’Océanie, les Îles de l’Océan Indien (Réunion, Madagascar,…) et la côte orientale d’Afrique, l’Amérique tropicale et les Caraïbes. L’Afrique de l’Ouest, quant à elle, représente une situation encore mal expliquée, caractérisée par une circulation du virus parmi les singes et par l’isolement sporadique de souches alors que les cas humains demeurent très peu nombreux. L’Afrique centrale demeure apparemment indemne de la dengue. Le bassin méditerranéen, autrefois soumis à de vastes épidémies, fut rendu non réceptif à la suite de la disparition d’Aedes aegypti, le seul vecteur qui s’y trouvait. Mais l’introduction d’Aedes albopictus dans certains pays de la région constitue aujourd’hui une menace non négligeable (4).
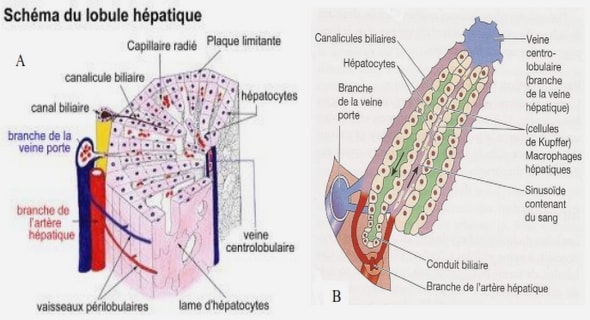
Structures du virus de la dengue
Le virus de la dengue est un petit virus enveloppé, mesurant 50 nm. Son génome est une molécule d’ARN monocaténaire de polarité positive d’environ 11 000 bases. L’extrémité 5′ du génome viral possède une coiffe de type I et l’extrémité 3′ est dépourvue d’une queue de poly(A). L’ARN génomique est associé à plusieurs copies de la protéine de capside C pour former la nucléocapside. Cette dernière est entourée d’une enveloppe virale constituée d’une double couche lipidique issue des membranes du réticulum endoplasmique où sont ancrées la protéine d’enveloppe E et la protéine de membrane M. La protéine E, présente sous la forme d’un homodimère dans la particule virale, est impliquée dans la reconnaissance du récepteur viral à la surface cellulaire et dans l’activité fusogène du virion. Les anticorps neutralisants du virus de la dengue sont principalement dirigés contre la protéine E. L’ARN génomique du virus de la dengue contient un unique cadre de lecture ouvert d’environ 10 500 nucléotides flanqués de deux courtes régions non codantes à ses extrémités 5′ et 3′. Le génome est traduit en une polyprotéine d’environ 3400 acides aminés, clivée co- et post-traductionnels pour donner dans sa partie N-terminale les protéines structurales C, prM (le précurseur intracellulaire de M) et E, suivies de 7 sept protéines non structurales majeures (NS) de NS1 à NS5. La protéine NS3 assure les fonctions de protéase virale et d’hélicase à ARN. La protéine NS5 porte les activités de polymérase à ARNdépendante de l’ARN et de méthyltransférase lui permettant d’assurer d’une part la réplication des molécules d’ARN du virus et, d’autre part, la mise en place de la coiffe à l’extrémité 5′ du génome viral.
Les quatre virus en cause sont proches les uns des autres, mais pas assez toutefois pour entraîner, chez l’homme, une protection croisée efficace et durable.
Cycle du virus chez le moustique adulte
Chez les moustiques vecteurs, seule la femelle est hématophage. Elle doit consommer du sang (de préférence humain) pour assurer ses fonctions reproductrices. A l’occasion d’un repas sanguin sur un malade, elle peut donc s’infecter avec un virus de la Dengue. Celui-ci pénètre dans les cellules du tube digestif et se multiplie activement. Par la suite, les virus envahissent l’ensemble de l’organisme du moustique, notamment les glandes salivaires. Après 7 à 14 jours, le moustique contaminé peut à son tour transmettre le virus par piqûre. Il s’agit donc d’un processus actif, où le vecteur joue aussi le rôle de réservoir et d’amplificateur du virus. Il n’est néanmoins pas affecté par le virus et reste infecté pendant toute sa vie. Il y a un passage transovarien du virus chez l’Aedes femelle. Les œufs pondus sont parfois infectés et ils peuvent donner naissance à des larves puis des adultes, spontanément vecteurs de la dengue. Ces œufs ont la particularité d’être résistants, pouvant s’accrocher aux parois de tous récipients potentiels (récipients destockage d’eau tels que: citernes, fûts, jarres…, ou récipients abandonnés exposés à la pluie tels que: boîtes de conserve, pneus, carcasses de voitures…). A la fin de la saison humide, les œufs sont capables de survivre à la sécheresse, jusqu’à la saison humide suivante. S’ils sont infectés par un virus de la Dengue, leur éclosion, plusieurs mois après la fin d’une période de transmission, peut se traduire par une réapparition d’une circulation virale. Ce phénomène, bien que marginal, peut expliquer la réapparition de foyers de dengue à distance d’une épidémie et sans réintroduction du virus. On voit, là encore, le rôle du moustique dans l’amplification, la dissémination et l’endémisation (persistance dans le temps) de la maladie.
Multiplication des virus chez l’homme
Chez l’homme, à la suite de l’injection de salive lors de la piqûre d’un arthropode infestant, le vertébré réceptif va développer une infection arbovirale. Le virus va se répliquer à proximité du point d’inoculation, puis dans les ganglions lymphatiques correspondants : c’est la phase de virémie. Puis, le virus va se disséminer dans l’organisme jusqu’aux organes cibles. L’infection entraîne une réponse immune à la fois humorale et cellulaire. La réplication des virus se déroule dans le cytoplasme, en association étroite avec les membranes intracellulaires. En général, les premières synthèses virales sont détectées une dizaine d’heures après le début de l’infection et la production des particules virales est maximale après la 24e heure. Les effets cytopathiques peuvent survenir après 40 heures d’infection (4) (7).
Les glycosaminoglycanes de type héparane sulfate à la surface de la membrane plasmique contribuent à l’attachement du virion à la surface cellulaire (a). Le virion associé à la surface cellulaire pénètre dans le compartiment intracellulaire par endocytose (a,b). Les membranes virales fusionnent, à pH acide, avec les membranes endosomales, libérant la nucléocapside (NC) dans le cytosol (c). L’étape de décapsidation permet à l’ARN génomique d’être traduit et les protéines virales synthétisées vont assurer la formation des complexes de réplication nécessaires à la réplication de l’ARN viral (d). Les ARN à double-brins (FR : formes réplicatives) (e) qui appartiennent aux acides ribonucléiques sens et anti-sens sont à la base de la formation des ARN partiellement bicaténaires (IR : intermédiaire de réplication), et la synthèse de novo des brins d’ARN de sens positif et de taille génomique (f). Les ARN viraux néo-synthétisés sont d’une part requis pour la production massive des protéines virales (g) et, d’autres part, associés aux protéines C (sphères de couleur bleue pâle) pour constituer les nucléocapsides (h). Par la suite, ces nucléocapsides s’entourent de l’enveloppe par un processus de bourgeonnement au sein des membranes du réticulum endoplasmique où sont ancrées les glycoprotéines de l’enveloppe virale prM et E associées en hétérodimères non covalents (i). Les provirions migrent à travers les compartiments de la voie de sécrétion dans des vésicules de transport (j,k). Lors de leur passage dans le compartiement trans-golgien, le clivage protéolytique de prM en M par les protéases est l’étape finale de la morphogenèse virale qui permet aux particules virales de devenir totalement infectieuses. Les virions infectieux sont finalement relargués dans le milieu extracellulaire (m). Dans les cellules de mammifères, la glycoprotéine NS1 (sphère jaune) est retrouvée dans le milieu extracellulaire sous la forme d’un hexamère.
La réplication du virus de la dengue dans les cellules cibles de l’infection comme les neurones, les cellules hépatiques et les cellules endothéliales déclenche la mort cellulaire par apoptose. C’est un processus actif de destruction qui agit comme une réponse d’urgence à l’infection virale.
Pouvoir pathogène
La fièvre dengue ou la dengue classique est la forme la plus courante de la maladie. Après une incubation d’environ une semaine, le début de la fièvre est particulièrement brutal. Elle atteint 39 à 40°C, accompagnée de frissons, de très vives céphalées, surtout frontales, de douleurs ostéo-articulaires intenses prédominant aux extrémités. Parfois se manifestent également une photophobie, des troubles digestifs, des adénopathies. Cette première phase est suivie d’une rémission transitoire inconstante, d’environ 36 heures. Au 5ème ou 6ème jour, réapparaissent la fièvre, qui se maintiendra en plateau entre 39 et 40 °C, et son cortège de signes généraux (malaise général, asthénie, photophobie, bradycardie, anorexie, adénopathies…). Les douleurs sont souvent au premier plan, notamment arthralgies, myalgies, céphalées. Une éruption peut inconstamment être observée à type d’exanthème maculeux ou maculo-papuleux prédominant sur le tronc, mais s’étendant parfois aux membres et à la face. Ce rash cutané est souvent accompagné de prurit et d’hyperesthésie cutanée, rarement cette éruption cutanée a un aspect pétéchial. Au bout d’une semaine environ survient une défervescence assez brusque, accompagnée de la régression spontanée de tous les signes. Cette dengue classique est donc une affection essentiellement bénigne, puisqu’elle guérit spontanément, et sans séquelle. L’état général du patient peut aussi brutalement s’aggraver avec l’apparition des signes hémorragiques qui caractérisent la fièvre hémorragique de dengue.
La fièvre hémorragique de dengue est une infection aiguë fébrile, caractérisée par des phénomènes hémorragiques et parfois par un syndrome de choc qui peut être mortel. Elle se différencie de la fièvre dengue par deux changements physiopathologiques majeurs, notamment une augmentation de la perméabilité vasculaire qui va entrainer une fuite plasmatique responsable d’une hémoconcentration, et un dérèglement de l’hémostase, impliquant une thrombopénie et une coagulopathie. Cette thrombopénie est d’origine mixte. D’une part, elle est d’origine centrale, causée par la destruction des mégacaryocytes par le virus de la dengue, réduisant ainsi la production médullaire de plaquettes. D’autre part, la thrombopénie est d’origine périphérique. Elle est due à la destruction plaquettaire dans des organes tels que le foie et la rate ou à des auto-anticorps anti-plaquettes. Elle peut être aussi induite par l’agrégation excessive des plaquettes aux cellules vasculaires endothéliales infectées par le virus de la dengue, aboutissant ainsi à leur lyse. La dengue peut entrainer d’autres cytopénie notamment la leucopénie et l’anémie dont leur mécanisme est central. Elles sont induites par le virus qui infecte les cellules de l’hématopoïèse et altère leur capacité de prolifération, soit par destruction, soit par inhibition.
Au cours de la fièvre hémorragique, à la suite de l’incubation, le début de la fièvre est brutal, atteignant 39 à 40°C. Elle est accompagnée par de nombreux signes cliniques tels que frissons, céphalées, myalgies, arthralgies et de nausées. Habituellement sans rémission, vers le 2ème ou 3ème jour, dans la phase d’état de la maladie que marquent une altération rapide de l’état général, des éruptions volontiers purpuriques, des extrémités froides et cyanosées. La survenue de manifestations hémorragiques multiples notamment hémorragies digestives (hématémèses, méléna…), des hémorragies intracrâniennes (hématomes), hémorragies conjonctivales, épistaxis, gingivorragies. L’atteinte hépatique telle que la cytolyse est aussi observée. Le degré d’augmentation des transaminases serait pour certains auteurs un bon marqueur de la sévérité de l’atteinte dans sa forme hémorragique.
|
Table des matières
INTRODUCTION
I. REVUE DE LITTERATURE
I. 1. Historique
I. 2. Epidémiologie
I. 3. Structure du virus de la dengue
I. 4. Cycle du virus chez le moustique adulte
I. 5. Multiplication des virus chez l’homme
I. 6. Pouvoir pathogène
I. 7. Diagnostic
I. 7.1. Diagnostic clinique
I. 7.2. Diagnostic biologique
I. 8. Traitement et Prophylaxie
II. MATERIELS ET METHODES
II. 1. Objectifs d’étude
II. 2. Cadre et période d’étude
II. 2.1. Critères d’inclusion
II. 2.2. Critères d’exclusion
II. 2.3. Paramètres étudiés
II. 2.4. Dengucheck-WB
II.2.4.1. Principe
II.2.4.2. Mode opératoire
II.2.4.3. Lecture et interprétation des résultats
II.2.5. CareStart Malaria
II.2.5.1. Principe
II.2.5.2. Mode opératoire
II.2.5.3. Lecture et interprétation des résultats
III. RESULTATS
III.1. Résultat général de la population d’étude
III.2. Résultat général de la dengue diagnostiquée chez 198 patients
III.3. Résultat général des étiologies des fièvres diagnostiquées par les deux tests utilisés
III.4. Résultat qualitatif du Test Dengucheck-WB utilisé pour le diagnostic de la dengue
III.5. Résultat selon l’âge des patients affectés par la dengue
III.6. Résultat de la profession des patients affectés par la dengue
III.7. Résultat de l’automédication avec prise d’antipyrétique et d’antalgique des patients affectés par la Dengue
III.8. Résultat de la témpérature des patients affectés par la dengue
III.9. Résultat des signes cliniques associés à la fièvre chez les patients affectés par la dengue
III.10. Résultat de recherche des facteurs de risques de la dengue
III.11. Résultat des moyens de prévention contre les moustiques vecteurs du virus de la dengue
III.12. Résultat du traitement réçu, aux CSB II, par les patients affectés par la dengue
IV. DISCUSSIONS
V. SUGGESTIONS
CONCLUSION