Traits morphologiques
La famille de Clupéidae est constituée de petits poissons argentés au corps oblong plus ou moins comprimé. Des écailles lisses et caduques en chevrons forment une carène aiguë sur le bord ventral de l’abdomen. La bouche a une mandibule prognathe typique du groupe. Il n’existe qu’une seule nageoire dorsale, sans rayon épineux située au milieu du dos, la caudale est fourchue bien échancrée. Les clupéidés ont un système branchial bien développé agissant comme un véritable filtre à plancton. C’est une famille cosmopolite qui comprend des espèces d’eaux froides et des espèces d’eaux chaudes, ces dernières étant les plus diversifiées (Seret, 1990).
Caractères distinctifs
La sardinelle ronde présente un corps allongé, généralement de section subcylindrique, parfois plus comprimé; ventre arrondi, mais avec un alignement de scutelles formant une carène faible sur le profil ventral. Opercule lisse; bord postérieur de la fente operculaire avec deux excroissances charnues; œil moyen; sommet du crâne avec de nombreuses stries (7-14) sur les frontopariétaux; bouche terminale; mâchoire supérieure arrondie, sans échancrure médiane; second supramaxillaire à bords supérieur et inférieur subégaux; branchiospines fines et nombreuses, plus de 80 sur la partie inférieure du premier arc branchial. Origine de la nageoire dorsale un peu en avant du milieu du corps; anale insérée bien en arrière de la base de la dorsale, ses deux derniers rayons prolongés, nettement plus longs que ceux qui les précèdent; pelviennes insérées sous la dorsale et à 9 rayons. Elle est plus arrondie que la sardinelle plate et sa carène ventrale est moins aiguë. Outre l’allure générale du corps, les deuxespèces peuvent se distinguer par le nombre de rayons de la nageoire pelvienne (9 chez la Sardinelle ronde et 8 chez la Sardinelle plate) et par leur coloration.S.aurita peut atteindre une taille maximale de 33 cm. (Fisher et al, 1987)
Coloration
La Coloration du dos est bleu-vert, les flancs argentés, avec à mi-hauteur une ligne dorée pâleprécédée d’une tache dorée en arrière de l’opercule; une tache noire distincte sur le bord postérieur de l’opercule (absence de pigment argenté sous-jacent); dorsale jaune plus ou moins foncé, ombrée sur le bord distal, à rayons antérieurs noirs, mais pas de tache noire à l’origine de la dorsale; pectorales jaune pâle moucheté de brun; caudale jaune très clair près de la base, le reste sombre avec les pointes très foncées ou noires (Fig.2). La sardinelle plate est de couleurgris-bleuté dorsalement avec les flancs et le ventre blanc-argenté sans bande dorée, une tache diffuse et sombre est située en arrière de l’opercule et il en existe une à la base des premiers rayons de la dorsale (USAID, 2012). Les pectorales sont noires entre des rayons blancs dans la partie supérieure, incolores au-dessous (Photo 1).
Régime alimentaire de Sardinella aurita
S.aurita en tant que poisson petit pélagique planctonophage, constitue un des maillons essentiels de la chaîne alimentaire marine (Fréon, 1988), plus riche en phytoplancton chez les juvéniles. Les copépodes constituant une part importante de sa ration alimentaire (Cury et Fontana 1988 ;Nieland ,1980). On note aussi la présence des euphausides et des larves de cirripèdes et cladocères. On constate pour S.aurita une possibilité d’alimentation à base de « détritus » tels que des particules de sables mélangées à des Diatomées dont l’ingestion remplacerait le manque d’aliments en période de faible abondance du plancton. Plus au large (fonds de 52 m), les individus pêchés ont un régime composé essentiellement de phytoplancton (Nieland, 1980).
En Mauritanie, la période la plus riche de phytoplancton se situe entre septembre et mai. Les moyennes mensuelles de la biomasse, relativement élevées, présentent cependant quelques variations : de 160 à 260 mg /m3 en mars. Les plus fortes concentrations sont rencontrées en février –mars dans la partie sud du banc d’Arguin et à proximité du cap Blanc. Au sud du cap Timiris, en dehors des zones d’upwelling très restreintes, se développent de Diatomées cosmopolites :Chaetoceros curvicetum, Schroederella delicatulaet Rhizosolenia delicatula.
Le phytoplancton est très riche en coccolithophoridésqui peuvent constituer 30 à 60% des effectifs (Andronov et Maigret 1980).
Reproduction
L’étude de la reproduction des poissons est une approche indispensable pour la connaissance et la description des caractéristiques biologiques et dynamiques du stock. Pour cela différentes études ont abordé les différents aspects de la reproduction des poissons, que se soient, le sex-ratio, la taille de première maturité, la fécondité, la saison et la durée de la reproduction. Ces caractéristiques sont pratiques pour l’aménagement des pêcheries (Jennings et al., 2001), en particulier pour les pêcheries pélagiques monospécifiques . Sardinella aurita (Valenciennes, 1847) est un poisson gonochorique (à sexe séparé) considéré comme reproducteur totale (isochrone) du fait qu’il effectue une seule ponte par cycle annuel. La détermination du rapport des sexes (sex-ratio) et de la suite des changements du stade de maturité au cours de l’année sont d’une très grande importance pour édifier une connaissance précise de la biologie générale d’un stock exploité. C’est une partie de la base de l’évaluationdes stocks (Bouaziz, 2007).
Le cycle de maturation des gonades et le rapport gonado-somatique (RGS)
Dans la région sénégalo-mauritanienne, Sardinella aurita se reproduit toute l’année avec un maximum de juin à septembre. La ponte n’est pas simultanée dans l’ensemble de la zone et un foyer de reproduction maximale se déplace du sud au nord, de la Gambie en mai au Cap Blanc (21″ N) en août. En un même lieu, on observe des alternances d’activité sexuelle et derepos. Les jeunes vivent près des côtes et se regroupent en deux nourriceries, l’une du CapVert, l’autre dans la région du Banc d’Arguin et du Cap Timiris où ils restent jusqu’à une taille comprise entre 20 et 25 centimètres. Après s’être reproduits une première fois, ils rejoignent la fraction adulte de la population. Les adultes, de longueur supérieure à 25 cm, se déplacent parallèlement aux côtes recherchant préférentiellement les zones de convergence situées à proximité des remontées d’eaux froides. Dans leur majorité, ils suivent le cycle migratoire suivant: phase de dispersion d’octobre à janvier dans la partie nord de la zone (Mauritanie), descente rapide vers le sud en janvier-février, concentration de préponte en mars avril dans la partie sud de la région (sud Sénégal) et montée vers le nord de mai à juillet tout en se reproduisant.
Les sardinelles rondes de la région sénégalo-mauritanienne constituent donc une population unique dont la fraction adulte accomplit une migration annuelle entre 11° et 25° N.
Deux périodes ont été considérées dans le cycle de vie pour cette étude: la phase juvénile et la phase adulte.
Selon ces auteurs, (Boëly et al., 1982 ; Fréon,1988 ; Cury et Fontana,1988 ;Lévénez, 1993 ; Diouf et al., 2010 ; Samba, 2011) le cycle sexuel de cette espèce dans la zone sénégalomauritanienne présente les caractéristiques suivantes :
– La ponte est étalée sur toute l’année si l’on considère toute la zone avec une période de reproduction maximale entre mai en septembre.
– La zone de ponte principale s’étend de la Gambie (maxima de reproduction dans le mois de juin) au Cap Blanc (arrive en mois de septembre).
– Dans une région donnée, la période de ponte est très étalée avec deux périodes, une principale et l’autre secondaire séparé par des périodes de repos sexuel.
Dans la zone mauritanienne, il y aurait deux périodes de ponte, une en aôut dans la saison chaude (25C°) et l’autre en décembre dans les eaux plus froides (18C°), au large du cap blanc responsable de la biomasse importante des juvéniles observée en février et mars (Ould Talib Sidi,2005). La reproduction du mois d’aôut semble peu contribuer au recrutement. Ainsi les juvéniles sont peu abondants en décembre et on observe une forte abondance des adultes dans ce mois (Marchal E, 1977). La distribution des fréquences des tailles dans les différents trimestres analysées montre la présence des juvéniles (tailles inferieure a 18 cm) dans les trois premiers mois de chaque année. Ce constat rejoint l’hypothèse émise par Marchal(1977) quistipule que la ponte du mois de novembre-décembre est la seule qui participe pleinement au recrutement.
Micronutriments (fer, cuivre etmagnésium)
Les minéraux et oligo-éléments
L’organisme humain a besoin d’une vingtaine de minéraux qui doivent être apportés régulièrement par l’alimentation pour compenser les pertes journalières (urines, selles, transpiration …) ou pour satisfaire des besoins augmentés dans certaines situations physiologiques (croissance osseuse, grossesse, allaitement, menstruation …).
Les minéraux et oligo-éléments sont indispensables au bon fonctionnement de l’organisme : ilsinterviennent dans de nombreux processus biologiques, soit comme constituants (exemple : calcium et os), soit comme cofacteurs dans divers métabolismes (fer et hémoglobine pour letransport de l’oxygène). Certains de ces éléments sont nécessaires dans des quantités del’ordre du gramme (exemple : calcium), ce sont des macro-éléments, d’autres dans desquantités de l’ordre de quelques milligrammes : ce sont les oligo-éléments. Tous doivent êtreapportés par une alimentation équilibrée car l’organisme ne peut pas les synthétiser.
Le Fer dans l’organisme
Le fer est un élément chimique, de symbole Fe et de numéro atomique 26. L’organismehumain contient 3 à 4 g de fer. Il existe sous deux formes : fer fonctionnel (dans l’hémoglobine et la myoglobine où il assure notamment le transport de l’oxygène), fer de réserve (stocké dans le foie, la rate, la moelle osseuse au sein des protéines).
Le rôle du fer
Le fer est l’oligo-élément le plus abondant dans notre organisme; il est nécessaire aux fonctions de l’hémoglobine, de la myoglobine et des protéines de la chaîne respiratoire, et notamment dans le transport de l’oxygène au niveau des globules rouges du sang .Il joue un rôle similaire dans la myoglobine qui est la forme de réserve de l’oxygène dans le muscle. De plus, le fer intervient comme composant de nombreuses enzymes. Le fer joue un rôle fondamental dans l’infection microbienne (Bell ,1991). Une alimentation équilibrée et variée assure les besoins en fer de l’enfant et de l’adulte, mais la femme enceinte, allaitante, lenourrisson, le dialysé, et parfois aussi l’adolescent doivent être surveillés pour éviter l’anémie ferriprive (Bruno, 2012).
Régulation de l’absorption du fer Absorption du fer héminique
L’absorption du fer contenu dans les aliments d’origine animale (viande et poisson), appelé fer héminique, est assez peu influencée par la composition de l’aliment avec un taux d’absorption de 20% environ (Gurio, 1991). En fait le noyau du fer héminique est absorbé telsque par les cellules de la muqueuse intestinale.
Selon Refsum et Schnreiner(1984), le fer héminique passe dans l’entérocyte sous forme d’un complexe porphyrine-fer d’où le fer est libéré. Il existe une régulation au niveau des cellules de la muqueuse intestinale. C’est ainsi que l’absorption s’accroit en cas d’hématopoïèse accrue par suite d’une anémie, durant la grossesse ou pendant la lactation. Par contre elle diminue nettement s’il a du fer en excès (Lombard et al,1997).
L’anémie par carence en fer
Dans beaucoup de pays en développement, l’anémie par carence en fer est un grand problème de santé publique qui touche dans certains cas la moitié des femmes et des enfants (Demaeyer et Adiels ,1985).
Selon L’OMS (1999), l’anémie nutritionnellepeut être définie comme un état pathologique dans lequel la teneur du sang en hémoglobine est devenue anormalement faible à la suite de la carence en un ou plusieurs nutriments essentiels et quelle que soit la cause de cette carence.
C’est en fait la conséquence clinique d’une balance de fer négative où les pertes sont plus importantes que l’apport.
La carence en cuivre
Peut être responsable de maladies de la peau ou de troubles nerveux. On a découvert que le cuivre est un constituant de plusieurs amines oxydases. Si l’on a observé des anomalies de la synthèse de l’élastine vasculaire, du tissu conjonctif et du collagène du tissu osseux dans plusieurs espèces chez des sujets carencés en cuivre, il est probable que ces anomalies sont la conséquence d’une diminution concomitante de l’activité des amines oxydases des tissus (Underwood et Suttle ,1999).
Toxicité
La tolérance au cuivre de la plupart des espèces ayant une seule poche gastrique est élevée.
Ainsi, dans son quatorzième rapport, le Comite mixte (FAO/OMS, 1971) d’experts des Aditifs alimentaires a conclu que, dans la mesure ou l’apport quotidien de cuivre ne dépasse pas 0,5 mg/kg de poids corporel, il n’y a aucun effet délétère à craindre pour l’homme.
Magnesium
Le magnésium est un élément chimique, de symbole Mg et de numéro atomique 12. Le magnésium est un métal alcalino-terreux. C’est le huitième élément le plus abondant de la croûte terrestre. En solution, il forme des ions Mg 2+.
Certains sels de magnésium sont très solubles dans l’eau le carbonate précipite (dureté magnésienne); l’hydroxyde est pratiquementinsoluble. L’ion magnésium Mg 2+ est en proportion le deuxième ion le plus présent dans les cellules après le potassium (Palangié, 2012). Il intervient dans plus de 300 réactionsmétaboliques. Le magnésium est le troisième composant des sels dissous dans l’eau de mer.
En eau de mer, la concentration en magnésium est d’environ 53 mmol . Le magnésium est le quatrième minéral le plus abondant dans le corps.
Le corps renferme 20 à 30 g de magnésium, dont 60 pour cent se trouvent dans les os, sous la forme de phosphates ou de carbonates. (Palangié, 2012)
Impact socio-économique
La valorisation ou la transformation des produits et coproduits halieutiques sur toutes les formes existantes, constitue un atout majeur pour le développement économique et social des populations (Arvanitoyannis et al, 2008). La quantité totale produite en 2012 est de 22 800 tonnes de farine et 5 500 tonnes d’huile de poissons. Environ 10% de la matière première transformée à Nouadhibou est composée de déchets de poissons essentiellement de petits pélagiques, issus des autres usines de produit élaboré, contre 2% à Nouakchott. Le poisson frais transformé est composé exclusivement de la famille de clupéidé, qui représente 91% à Nouadhibou ( 50% d’ethmalose (Obo), 32% de sardinelle ronde et 18% de sardinelle plate) 98%à Nouakchott (sardinelle ronde (52%) etsardinelle plate (48%), l’ethmalose (Obo) ne représente qu’environ 1%). IMROP(2012)
Suivant les prix moyens de farine et huile de poissons appliqués en 2012 sur le marché international 1771 dollars American pour la farine et 600 dollars American pour l’huile, cette production a une valeur très importante (18,835 Millions $ Américains), mais le nombre d’emploi généré reste très bas. Il équivaut à 232 emplois dont 128 fixes et 104 temporaires Levolume des effluents (pollution) est évalué enpremière approximation à 11 520tonnes/an, dont 1080 tonnes de rejet solide et lereste sous forme de rejetliquide.
Il est nettement clair quel’e xportation de la farine et l’huile depoisson constitue unesource des devises de plus en plus importante pour laMauritanie, notamment avec la flambé des prix de ces produits sur le marché mondial.
Impact environnemental de l’implantation des usines
Les industries de pêche, de conserverie ou de filetage, la manipulation des produits de capture, etc. génèrent beaucoup de déchets ou produits halieutiques impropres à la consommation et à faible valeur commerciale. Tous ces déchets lorsqu’ils sont abandonnés, engendrent des problèmes de pollution de l’environnement. Cependant, la transformation de ces déchets en farines de poisson et leur valorisation à diverses fins diminuent cette pollution et constituent donc un effet bénéfique pour l’environnement et pour le bien-être des populations (Arvanitoyannis et al. 2008 ).
La note de commentaire réalisé par l’IMROP suite à une demande de l’autorité locale, a pu tirer les conclusions suivantes :
Tous les déchets de poisson et toutes les eaux résultant des options de transformation doivent être évacués. Il n’est pas rare que le réservoir qui fournit l’eau nécessaire au renouvellement des eaux usées soit lui–même contaminé. Il est évident que si les déchets ne sont pas convenablement traités, ils pollueront les eaux et les rendront impropres à l’utilisation. Cela pourra considérablement altérer le bilan biologique de l’eau et affecter la vie de la faune et de la flore ;
Les odeurs dégagées par les usines de farine et des huiles de poisson sont parfois désagréables, et, si elles ne font l’objet d’aucun traitement, peuvent nuire à la santé des populations surtout limitrophes.
D’autre part, si avec la forte demande engendrée par le développement des conserveries à Nouadhibou, il y’a, en plus un appel pour traiter par jour des centaines de tonnes de sardinelles en vue de produire des dizaines de tonnes de protéines de poisson, le risque de surexploitation devient alors plus voyant . (IMROP, 2012)
Valeur nutritionnelle et qualité des farines de poisson
Les caractéristiques nutritionnelles recherchées dans les farines de poissons sont fonction du taux de leurs différents éléments constitutifs ou nutritifs, des besoins ou des espèces animales. Du fait de leur haute valeur nutritive, les farines de poisson constituent souvent l’une des principales matières premières animales les plus utilisées dans l’alimentation animale (Bourdon et al. 1984 ; Sauvant et al. 2004).
Composition chimique des farines de poisson
Protéines brutes ou matières azotées totales des farines de poisson
Les protéines des farines de poisson renferment tous les acides aminés y compris les acides aminés indispensables comme la lysine, la méthionine et la cystéine qui sont généralement à faible concentration ou souvent absentes dans la plus part des autres sources de protéines alimentaires (céréales, tourteau, …) et qui constituent donc un facteur limitant dans les régimes alimentaires. Les acides aminés contenus dans les farines de poisson sont très digestes, facilement absorbables et facilitent donc l’assimilation des aliments par les animaux et certaines farines de poisson peuvent avoir des taux de protéines allant jusqu’à 70% et même au-delà. (Bourdon et al., 1984 ; Sauvant et al, 2004).
Discussions
Dans nos résultats les teneurs moyennes en fer dans la chair des différents échantillons analysés sont de 2,72mg/100g pour sardinella aurita. Des résultats similaires aux nôtres ont été obtenus dans le Thon par Lall., (1995). Ils ont rapporté une concentration en fer égale à 2,8mg/100g. Cependant Mohamed et al (2012) ont obtenu des teneurs en fer (6 ,2 mg/100g) deux fois supérieures aux nôtres dans Sardina pilchardus au Maroc.
La teneur moyenne en fer des poissons prélevés à Nouadhibou est de 2 ,96 mg/kg alors que pour ceux prélevés à Nouakchott la teneur moyenne est 2,59 mg/kg. On peut expliquer cette différence par l’existence du plus grand port dans le pays destiné à l’exportation du fer vers les marchés internationaux avec la présence de rejets industriels à Nouadhibou (port de minéraux).
S.aurita en tant que poisson petit pélagique planctonophage, constitue un des maillons essentiels de la chaîne alimentaire marine. (Freon., 1988). On constate pour S.aurita une possibilité d’alimentation à base de « détritus » tels que des particules de sables mélangées à des Diatomées dont l’ingestion remplacerait le manque d’aliments en période de faible abondance du plancton (Nieland . , 1980).
Le fer peut être un facteur significatif pour la croissance du phytoplancton dans la région Nord ouest africaine (Duc et Tindal., 1991).
Les teneurs moyennes en cuivre dans la chair des différents échantillons analysés de Sardinella aurita sont de 0,05± 0,01 mg/100g (Min : 0,03 mg/kg Max0, 08 mg/100g ; CV : 25%). Cette concentration moyenne est 4 fois inférieure à celle trouvée par Mohamed et al (2012) dans Sardina pilchardus au Maroc.
La teneur moyenne en cuivre à Nouadhibou est de 0,053 mg/100g tandis qu’à Nouakchott la teneur est 0,051 mg/100g. Alors que les teneurs moyennes en magnésium dans la chair des différents échantillons analysés de Sardinella aurita sont de 36, 22 ± 0,01 mg/100g. Cette teneur est de tandisqu’à 36,34 à Nouadhibou elle est de 35,87 mg/100g à Nouakchott. On peut expliquer cette différence par la présence du port minier à coté du site de prélèvement à Nouadhibou. La teneur moyenne en magnésium (36,2 mg/100g) obtenue dans notre étude concorde avec celles de Murrayet Brut(1969) dans le muscle du poisson qu’ils ont observé (38 mg/100g).
|
Table des matières
INTRODUCTION
CHAPITRE I: Etudes Bibliographiques
I.1. Généralités
I.2 – La pêche du Sardinella aurita
2.1. Importance économique Du Sardinella auritaen Mauritanie
2.2 – Répartition géographique des sardinelles
2.3. Migration
I.3. Biologie et écologie de Sardinella aurita
I.4. Aspet zoologique général de laSardinella aurita
4.1- Systématique
4.2. Traits morphologiques
4.3. Caractères distinctifs
4.4-Coloration
4.5. Régime alimentaire Sardinella aurita
4.6 –Reproduction
4.7. Croissance
II. Les oligoéléments (fer, cuivre et magnésium)
II.1. Fer
1.1-Le fer dans l’organisme
1.2- Le rôle du fer
1.3 .Régulation de l’absorption
1.4- L’anémie par carence en fer
1.5. Conséquences de la carence en fer sur la santé des populations
2. Le Cuivre
2. 1.Lerôle du cuivre
2.2. La carence en cuivre
II.3. Magnesium
3.1 Rôle biologique
3.2. Estimation des besoins
33. Nature des manifestations de carence chez 1’homme
III- Histamine
1-Caractéristiques physico-chimiques de l’histamine
2. Importance des enzymes histidine-décarboxylases
3 .Origine de l’histamine
4. Rôle de l’histamine dans l’organisme
5. Mécanisme de formation de l’histamine dans le poisson
6. Dosage d’histamine
7. L’intoxication histaminique
IV. Métaux lourds
1. Mercure
1.1. Caractéristiques physico-chimiques
1.2. Les formes du mercure
1.3. Source du mercure
1.4. Intoxication
V-Farine de poisson
1. Définition
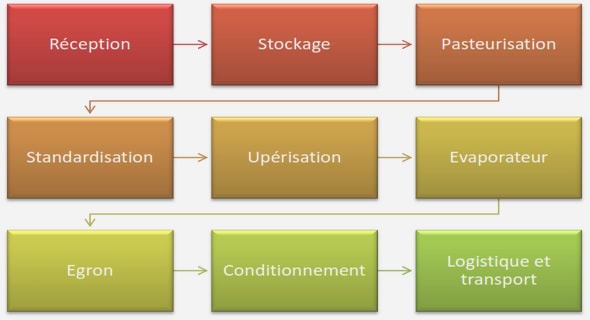
2. Procédés de transformation industrielle
3. Chaine de production de la farine
4. Principales espèces transformées
5. Exportation et commercialisation de la farine en Mauritanie
6. Caractérisation technique et localisation des principales usines à terre
7. Intérêts et utilisations de la farine de poisson
8. Impact environnemental de l’implantation des usines
9. Valeur nutritionnelle et qualité des farines de poisson
9.1. Composition chimique des farines de poisson
9.1.1- Protéines brutes ou matières azotées totales des farines de poisson
9.1.2. Lipides ou matières grasses des farines de poisson
9.1.3 Matières minérales et éléments minéraux des farines de poisson
9.1.4. Vitamines des farines de poisson
10. Utilisations de la farine de poisson
CHAPITRE II : Micronutriments (fer, cuivre, magnésium) dans Sardinella aurita en Mauritanie
1-Introduction
2-Objectif de l’étude
3- Matériel et Méthode
4–Résultats
4.1. La teneur en minéraux essentielles (Fer, Cuivre, et Magnésium) dans Sardinella aurita selon le site
4.2. Teneur de trois oligo-éléments (Fer, Cuivre, Magnésium) dans Sardinella aurita selon les sexes
4.3- Comparaison de la teneur en (Fer, Cuivre, et Magnésium) dans Sardinella aurita
5. Discussions
6. Conclusion
CHAPITRE III : La teneur en histamine et en mercure de la Sardinella aurita
I. La teneur en histamine
1. Introduction
2. Objectif de l’étude
3- Matériel et Méthode
4. Résultats
4. 1. Evolution de la teneur en histamine de Sardinella aurita à la température ambiante (31°C)
4.2. Évolution de la teneur en histamine à la température de réfrigération
4.3. Évolution de la teneur en histamine de Sardinella aurita à la température de Congélation (-20°C)
5. Discussion
6. Conclusion
II. La teneur en mercure
1. Introduction
2. Objectif
3. Matériel et Méthode
4-Résultats
4.1. Teneur en Mercure de Sardinella aurita en Mauritanie
4.2. Etude statistique
5. Discussion
6 .Conclusion
CHAPITRE VI : Qualité nutritionnelle de la farine de Sardinella aurita
1. Introduction
2. Objectif de l’étude
3. Matériel et Méthode
4. Résultats
4.1. L’évolution du taux(%) de protéine dans la farine de Sardinella aurita
4.2. L’évolution du taux(%) du graisse dans la farine de Sardinella aurita
4.3. L’évolution du taux(%) de cendre dans la farine de Sardinella aurita
4.4. L’évolution du taux(%) de l’humidité dans la farine de Sardinella aurita
4.5. Etude statistique
5. Discussion
6. Conclusion
Conclusion générale et perspectives
Références bibliographiques