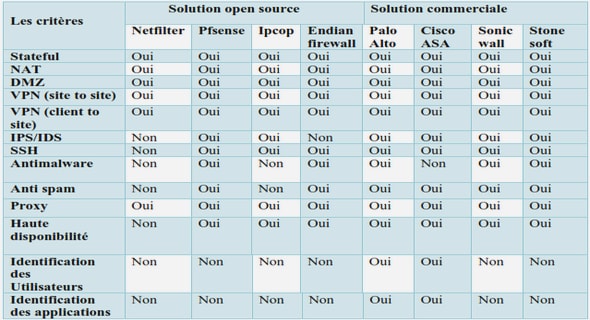
Télécharger le fichier pdf d’un mémoire de fin d’études
Physiopathologie des shunts
Les shunts peuvent être de type droit → gauche (cyanogène), gauche → droit (non-cyanogène), ou thérapeutique (pour améliorer le débit pulmonaire). Leur débit est fonction du diamètre de l’orifice (ou du conduit), de la pression dans la cavité d’amont et de la résistance au flux dans la cavité d’aval.
Shunt gauche → droit (CIA, CAV, CIV, canal artériel) (Figure 2) il diminue si les RAS baissent ou si les RAP augmentent. La surcharge du circuit pulmonaire conduit plus ou moins rapidement à une hypertension pulmonaire. Une SaO2 élevée n’est pas la garantie que le transport d’O2 (DO2) soit satisfaisant; avec un rapport Qp/Qs ≥ 3:1, le DO2 diminue même si le sang artériel est correctement oxygéné (risque de cyanose).
Le but premier de la prise en charge d’un enfant porteur de shunt est d’équilibrer les flux pulmonaire (Qp) et systémique (Qs), et d’obtenir un rapport Qp/Qs voisin de 1:1. Pour ce faire, on modifie les RAP et les RAS de manière à baisser le Qp dans un shunt G-D (RAP élevées et RAS basses) et à augmenter le Qp dans un shunt D-G cyanogène (RAP basses et RAS élevées).
Dans le premier cas, on diminue la FiO2 et on augmente la PaCO2 pour induire une acidose respiratoire. Dans le deuxième cas, au contraire, on augmente la FiO2 et on baisse la PaCO2 pour créer une alcalose. Lors de shunt D-G cyanogène, la manoeuvre ne vise pas l’obtention de la SaO2 la plus haute possible, mais l’équilibre entre les deux circuits : le Qp doit assurer une SaO2 satisfaisante (souvent 75-85%) et le Qs un apport tissulaire normal (absence d’acidose métabolique). Le rapport Qp/Qs doit être aussi voisin que possible de 1. La présence d’un shunt potentialise les effets de l’hypovolémie sur la pression artérielle, à cause de la fuite constante de volume dans le circuit pulmonaire à basse pression.
Si le défect est de petite taille, le shunt est dit restrictif car le débit y est faible et le gradient de pression élevé. Le flux à travers l’orifice sera plus ou moins fixe et peu influencé par les changements du rapport entre les résistances vasculaires pulmonaires et systémiques (RAP/RAS). Ce type de shunt a une importance hémodynamique stable: il varie peu durant l’anesthésie et l’opération. C’est le cas des petites CIV.
Si le défect est grand, le shunt est dit non-restrictif : il y a peu de gradient ou même égalisation des pressions au travers de la communication. L’importance hémodynamique de ce type de shunt dépend du rapport RAP/RAS. Dans le cas extrême, le défect est tellement grand que les deux structures forment en fait une seule chambre commune (oreillette unique, ventricule unique). D’une manière générale, plus la taille du shunt est grande, plus son débit dépend du rapport entre les RAP et RAS. Les shunts situés au niveau ventriculaire (CIV) et artériel (canal artériel) dépendent du rapport RAP/RAS, alors que les shunts situés au niveau auriculaire (CIA) dépendent davantage de la compliance des cavités droite et gauche.
D’une manière générale, le shunt cause une dilatation de la cavité de réception et une surcharge de travail pour le ventricule d’amont. Un shunt G-D au niveau ventriculaire (CIV) ou artériel (canal artériel) augmente le débit pulmonaire, donc le retour veineux au coeur gauche; il occasionne primairement une surcharge de volume du VG ; l’augmentation progressive des RAP induit secondairement une surcharge de pression du VD. Le shunt G-D en amont des valves auriculo-ventriculaires (CIA) crée une surcharge de volume pour le VD [21].
Physiopathologie de l’hypertension artérielle pulmonaire
Les cardiopathies congénitales peuvent augmenter ou abaisser le débit pulmonaire (Qp). L’augmentation du flux sanguin pulmonaire par un shunt G-D entraîne une élévation progressive des résistances artérielles pulmonaires (RAP), responsable secondairement d’une hypertrophie du VD. L’hypertension artérielle pulmonaire (HTAP) est définie par une PAP moy > 25 mmHg au repos, ou des résistances vasculaires pulmonaires (RAP) > 250 dynes·s·cm-5 (> 3 U Wood/m2) [13, 19]. Elle survient dans 50% des cas de CIV et de canal AV, où il y a surcharge de volume et de pression, mais dans seulement 10% des CIA, où il y a surcharge de volume uniquement. Elle apparaît dans la petite enfance lors de CIV, mais seulement à l’âge adulte en cas de CIA [51].
Le stress pariétal vasculaire provoqué par le flux pulmonaire excessif empêche la normalisation des RAP pendant les premiers mois de vie et cause une extension de la musculature lisse dans des vaisseaux périphériques qui ne sont normalement pas musculaires. La persistance d’un haut débit pulmonaire et d’une PAP excessive induisent une hypertrophie de la média des artères plus proximales, accompagnée d’une prolifération intimale progressive, de lésions plexiformes et d’une fibrose (Figure 5) [52, 55]. Finalement, l’arborisation est inhibée et le nombre des vaisseaux distaux diminue : l’HTAP est fixée et irréversible. C’est le syndrome d’Eisenmenger, caractérisé par une PAP moyenne > 50 mmHg et des résistances vasculaires pulmonaires > 800 dynes•s•cm-5. Le flux à travers le shunt G-D est alors bidirectionnel ou renversé. Face à cette surcharge de pression, le VD subit une hypertrophie massive et s’épaissit considérablement. Le travail respiratoire est augmenté et les résistances des voies aériennes sont élevées à cause de l’excès de flux pulmonaire. La dilatation des artères pulmonaires peut comprimer les bronches. Lorsque les RAP sont plus des deux tiers des RAS (RAP/RAS > 0.7), la chirurgie réparatrice n’est plus possible.
Classification des cardiopathies congénitales
D’un point de vue physiopathologique, les cardiopathies congénitales sont classées de manière fonctionnelle en référence au flux sanguin et aux conséquences hémodynamiques de leur anatomie [21]. Cette classification a l’avantage de correspondre aux différentes stratégies anesthésiques.
Cardiopathies non-cyanogènes avec shunt G-D
Dans cette catégorie, sont retrouvées les cardiopathies non-cyanogènes comme la CIA, la CIV, le canal AV, les retours veineux pulmonaires anormaux partiels ou le canal artériel qui surchargent la circulation pulmonaire. La cavité d’aval du shunt est dilatée : un shunt situé en amont des valves auriculo-ventriculaires crée une surcharge de volume pour le VD, alors qu’un shunt situé en aval de ces valves induit une surcharge de volume pour le VG; dans les deux cas, la pression de l’OG est élevée.
La fuite de sang artériel dans le circuit pulmonaire à basse pression abaisse la pression diastolique systémique ; ceci est particulièrement marqué lors de grand canal artériel. Le haut débit cardiaque (mVO2 élevée) et la diastolique basse font alors courir un risque d’ischémie myocardique, même si les coronaires sont normales.
Le shunt G-D peut conduire à une hypertension pulmonaire (HTAP) ; celle-ci est d’autant plus sévère et plus rapide que la pression à travers le shunt est élevée. On diminue le shunt par une vasodilatation artérielle systémique et une vasoconstriction pulmonaire par hypoventilation. Lorsque le diamètre de la communication G-D dépasse les 75% de celui de l’aorte, les pressions systoliques aortique et pulmonaire s’égalisent ; le débit du shunt devient strictement proportionnel aux résistances vasculaires ; il peut même s’inverser si les RAP montent et les RAS baissent [17]. Ces cardiopathies sont paucisymptomatiques à la naissance, mais l’état clinique du nourrisson se détériore à la fin du premier mois de vie, lorsque les RAP baissent significativement : le shunt G-D augmente et l’insuffisance ventriculaire devient manifeste : tachycardie, congestion pulmonaire, fatigue et dyspnée lors de l’alimentation, retard de croissance.
Dans les shunts palliatifs (Blalock-Taussig, par exemple) et les collatérales aorto-pulmonaires, la situation est très différente parce que le débit pulmonaire est abaissé. Le débit du shunt, qui assure la circulation pulmonaire, est proportionnel à la pression systémique. La baisse des RAS le diminue et l’hypotension entraîne une chute de la SpO2. La pression diastolique systémique est basse à cause de la perte de charge dans le circuit pulmonaire à basse pression.
Les conséquences pour l’anesthésie sont multiples. Du point de vue pharmacocinétique, une substance injectée par voie intraveineuse est diluée par le sang artérialisé ajouté par le shunt ; son apparition artérielle est retardée et sa concentration circulante prolongée (demi-vie allongée). L’induction avec des agents intraveineux est ralentie. Au contraire, la captation et l’élimination des agents inhalés est accélérée vu le haut débit pulmonaire: le sang qui revient des poumons repasse dans l’artère pulmonaire et augmente son contenu en gaz dissout; la concentration sanguine est plus élevée [43]. En réalité, cet effet n’est visible cliniquement que si le shunt est supérieur à 60% et que le débit systémique est bas, augmentant ainsi la proportion du débit cardiaque qui perfuse le cerveau [65]. Du point de vue respiratoire, la surcharge vasculaire pulmonaire diminue la compliance des poumons et augmente le travail ventilatoire [67].
Le double but dans l’anesthésie de tels patients est d’augmenter les RAP et de baisser les RAS: Pour baisser les RAS : anesthésie générale avec isoflurane ou sevoflurane, éventuellement vasodilatateur artériel (phentolamine, nitroprussiate).
Pour augmenter les RAP, on induit une hypoventilation relative :
– FiO2 : 0.21 – 0.3 ;
– Hypoventilation avec hypercarpnie modérée (PaCO2 45 mmHg) ;
– Ventilation hyperbarique avec PEEP (augmentation de la postcharge du VD) ;
L’adjonction de CO2 aux gaz inspirés (FiCO2 : 2-4%) permet théoriquement de diminuer le vol systémique qu’opère le circuit pulmonaire à basse pression sans devoir hypoventiler avec un volume courant trop bas [39] ; cette mesure tend à augmenter également les RAS ; elle est très peu pratiquée ; certains centres l’utilisent lors d’arrêt circulatoire en CEC [64].
Maintien d’une relative hypervolémie : l’hypovolémie aggrave le shunt à cause de la séquestration obligatoire de volume dans le circuit pulmonaire à basse pression. La PVC n’est pas un bon indice de remplissage.
Augmenter l’Ht élève les RAP et freine le shunt G-D [48].
Après fermeture du shunt, le patient est hypervolémique, car le volume lié au shunt ne tourne plus dans le circuit pulmonaire mais surcharge la circulation systémique.
Cardiopathies cyanogènes avec shunt D-G présentant une diminution du flux pulmonaire
Dans ces pathologies, le flux pulmonaire est restreint à cause d’une obstruction sur la voie droite (atrésie tricuspidienne, sténose ou atrésie pulmonaire, tétralogie de Fallot) ; il dépend de l’apport par un canal artériel ou des collatérales aorto-pulmonaires. La cyanose est due à la baisse du Qp et au shunt D-G. Typiquement, la SaO2 est de 75-80% et l’hématocrite ≥ 50%.
Pour diminuer le shunt D-G et augmenter le débit par le canal artériel, s’il est encore perméable, il faut diminuer les RAP et augmenter les RAS: la SaO2 s’élève. L’enfant cyanosé le réalise spontanément par la position accroupie (squatting) qui augmente le retour veineux central, diminue le flux sanguin vers les jambes, et élève les RAS; on peut le provoquer par une compression abdominale externe de l’aorte, par des vasoconstricteurs artériels (phényléphrine, noradrénaline) ou des perfusions (augmentation de la volémie) [5]. Les RAP sont en général normales en aval de la sténose pulmonaire. Lorsque le flux pulmonaire dépend étroitement du canal artériel, une perfusion de prostaglandine (PGE1) permet de maintenir sa perméabilité le temps de réaliser une anastomose systémico-pulmonaire (shunt de Blalock). Le piètre transport d’O2 oblige à conserver une Hb haute (> 150 g/L), si nécessaire au moyen de transfusions.
La SpO2 surveille adéquatement le rapport Qp/Qs (variations relatives du Qp), mais la PetCO2 sous-estime la PaCO2 à cause de l’effet espace-mort induit par le volume sanguin court-circuitant les poumons. La réponse ventilatoire à l’hypoxémie est fortement diminuée, mais la réponse à l’hypercarpnie est conservée. L’hypovolémie, fréquente en salle d’opération, diminue la postcharge gauche ; elle est l’équivalent d’une vasodilatation artérielle systémique ; elle augmente le shunt D-G, donc la cyanose. Ces phénomènes sont moins marqués lorsque le shunt est restrictif. Conséquences pour l’anesthésie :
Le shunt D-G a une influence sur la pharmacocinétique. Le passage direct du retour veineux systémique vers la voie artérielle se traduit par un pic de concentration systémique plus rapide et plus élevé lors de l’injection intraveineuse d’une substance; l’induction intraveineuse est accélérée [62]. En réalité, cet effet théorique est atténué chez l’enfant pour trois raisons: l’augmentation du volume circulant, la baisse du débit cardiaque effectif, et l’augmentation de la fixation protéique [61]. Pour les agents inhalés, la situation est inverse de celle des agents intraveineux: la captation et l’élimination des halogénés sont ralenties à cause du faible débit pulmonaire et de la dilution du sang artérialisé par du sang veineux systémique [38]. De ce fait, leur effet inotrope négatif est moins aisément réversible. Cependant, ces effets ont une portée clinique limitée, parce qu’ils ne sont significatifs que pour les agents de solubilité intermédiaire (halothane, isoflurane) ou faible (sevoflurane, desflurane, N2O) lorsque le shunt est de l’ordre de 30-50% [41]. Plusieurs facteurs interviennent encore pour diminuer l’importance de ce phénomène: le bas débit cardiaque effectif, qui accélère l’élévation de la concentration alvéolaire de manière plus marquée pour les agents solubles, le rapport élevé entre la ventilation alvéolaire et la capacité résiduelle fonctionnelle du petit enfant, et la présence d’un shunt restrictif.
Le double but anesthésique dans ces cas est d’augmenter les RAS et de baisser les RAP :
L’anesthésie (halogéné, midazolam) et l’analgésie (fentanyl) doivent être profondes pour bloquer la réactivité vasculaire pulmonaire ; toute crise sympathique augmente les RAP et la sténose dynamique de la CCVD.
L’hyperventilation normobarique est préférable, avec une PEEP minimale pour exclure les atélectasies.
Les RAS effectives sont contrôlées avec un vasoconstricteur alpha (phényléphrine, noradrénaline) et un maintien de la volémie.
La sténose dynamique de la CCVD est contrôlée avec un β-bloqueur.
La SaO2 ne s’améliore qu’en diminuant le shunt, non en augmentant la FiO2. La SpO2 idéale est située entre 80% et 90%. Toutefois, la FiO2 peut avoir un effet sur la PaO2 dans la mesure où l’O2 induit une vasodilatation pulmonaire. Si la SaO2 et le débit pulmonaire sont bas, il est important de maintenir l’Ht > 40% pour assurer le transport d’O2 ; le seuil de transfusion est à 100-120 g/L Hb.
Cardiopathies cyanogènes avec shunt D-G présentant une diminution du flux aortique
Dans les cardiopathies cyanogènes avec restriction du flux systémique (hypoplasie du coeur gauche, hypoplasie ou interruption de l’arc aortique, coarctation très sévère), le débit pulmonaire est élevé mais le débit systémique dépend du canal artériel ; la cyanose prédomine à la partie inférieure du corps. L’hypoperfusion chronique peut conduire à une ischémie splanchnique et à une acidose métabolique.
La perméabilité du canal, maintenue au besoin avec des prostaglandines, est essentielle pour assurer la perfusion systémique. Les RAP doivent être élevées pour limiter le flux pulmonaire excessif et améliorer le débit systémique : FiO2 0.2-0.3, légère acidose respiratoire par hypercapnie permissive, éventuellement addition de CO2 au circuit inspiratoire en CEC. Un support inotrope est souvent nécessaire au ventricule sous-pulmonaire qui subit une surcharge de volume
Cardiopathies cyanogènes avec shunt mixte ou bidirectionnel
Dans ces pathologies (retour veineux pulmonaire anormal total, large CIV, valve AV unique, ventricule unique, TGV, truncus arteriosus), l’arbre pulmonaire n’est pas protégé par une sténose. La répartition du flux entre l’aorte et l’AP est fonction directe de l’équilibre entre les résistances artérielles systémiques et pulmonaires. Selon les variations anatomiques, c’est l’arbre pulmonaire ou l’arbre systémique qui reçoit le flux le plus important.
Lors de cardiopathies avec mélange du sang artérialisé et du sang veineux, le degré de cyanose (SaO2 ≤ 85%) dépend du rapport entre le flux pulmonaire (Qp) et le flux systémique (Qs). Comme les enfants cyanosés sont adaptés à une SaO2 basse, le but n’est pas d’obtenir la SaO2 la plus élevée possible, mais un rapport Qp/Qs voisin de 1 :1 ; ceci correspond souvent à une SaO2 de 75-85%. Si l’on recherchait la meilleure SaO2, on courrait le risque d’un flux pulmonaire excessif ; celui-ci entraînerait une décompensation ventriculaire et un bas débit systémique accompagné d’une ischémie et d’une acidose métabolique.
La prise en charge hémodynamique est déterminée par la prédominance du flux systémique ou pulmonaire. Les enfants avec une surcharge pulmonaire sont particulièrement difficiles à stabiliser : l’hyperventilation et l’hyperoxie augmentent encore le flux pulmonaire et entraînent une décompensation ventriculaire, alors que l’hypoventilation et une FiO2 basse augmentent le shunt et la cyanose.
Cardiopathies obstructives (non-cyanogènes sans shunt).
Une obstruction fixe à l’éjection ventriculaire dès la naissance (sténose valvulaire pulmonaire ou aortique, membrane sous-aortique, hypoplasie de l’AP ou de l’aorte) induit une hypertrophie ventriculaire concentrique droite (HVD) ou gauche (HVG). La prise en charge de ces cas est dominée par deux contraintes.
– Le maintien de la contractilité, qui est essentielle afin de ne pas entamer la capacité à générer des pressions élevées ; la menace d’une insuffisance systolique est toujours présente.
– L’insuffisance diastolique caractéristique de l’hypertrophie ventriculaire, qui rend le volume systolique très dépendant de la précharge; les pressions de remplissage sont plus élevées pour le même volume télédiastolique. L’hypovolémie et la perte de la systole auriculaire sont mal tolérées.
Une obstruction sévère sur l’arc aortique (hypoplasie, coarctation) peut entraîner une hypoperfusion systémique, avec acidose métabolique et ischémie digestive. Lors de sténose valvulaire ou sous-valvulaire aortique, l’hypotension systémique peut entraîner une ischémie myocardique par baisse de la pression de perfusion coronarienne.
Dans les sténoses aortiques et pulmonaires musculaires (infundibulaires), l’aspect dynamique est dominant : l’effet de sténose augmente avec la contractilité et diminue par β-blocage. L’obstruction diminue par effet inotrope négatif, par augmentation du volume circulant (hypervolémie) et par augmentation de la postcharge (vasoconstricteurs alpha); il faut éviter toute stimulation catéchol-aminergique β.
Les régurgitations valvulaires provoquent une hypertrophie excentrique du ventricule, avec une surcharge de volume et une augmentation des pressions de remplissage. Elles sont très sensibles aux variations de postcharge : une insuffisance mitrale (IM) ou aortique (IA) augmente si les RAS s’élèvent. En cas d’insuffisance tricuspidienne (maladie d’Ebstein) ou pulmonaire (IP) importantes, la régurgitation s’accentue si les RAP s’élèvent.
Préparation à l’intervention
Elle consiste en préopératoire d’améliorer le profil hémodynamique de l’enfant en traitant une insuffisance cardiaque décompensée, une HTAP sévère ou une infection pulmonaire.
Insuffisance cardiaque
Une dysfonction ventriculaire est fréquente chez les congénitaux. Elle est liée à plusieurs phénomènes :
– Le remodelage ventriculaire dû à la malformation
– La durée de la malformation
– Le type de surcharge: une surcharge de volume est mieux supportée qu’une surcharge de pression.
– La cyanose
– L’ischémie
Chez le petit enfant, l’insuffisance ventriculaire congestive se manifeste par des difficultés d’alimentation et un retard de croissance, et, dans les cas sévères, par une apathie et un cri affaibli. On voit aussi apparaître une irritabilité, une tachycardie, des efforts inspiratoires excessifs (rétraction intercostale, mouvement des ailes du nez) et une hépatomégalie. L’insuffisance ventriculaire droite est très fréquente chez les congénitaux. Son traitement repose sur :
– une oxygénothérapie
– administration de NO
– stimulation des récepteurs beta 1 et 2 :
dobutamine 3-10 mcg/kg/mn
isoprénaline bolus 10 mcg puis 0.01 à 0.1 mcg/kg/mn
adrénaline 0.01- 0.1 mcg /kg/mn (associée à la milrinone)
– anti- phosphodiestérase- 3 : milrinone : dose de charge de 50 mcg/kg puis perfusion 0.5- 0.75 mcg/kg/mn
– prostaglandines
HTAP
Les enfants de moins d’un an souffrant d’un haut débit pulmonaire secondaire à un shunt G-D de type ventriculaire ou artériel (CIV, canal atrio-ventriculaire, truncus arteriosus, shunt aorto-pulmonaire chirurgical, transposition des gros vaisseaux + CIV) sont à très haut risque de crises hypertensives pulmonaires paroxystiques dans la période peropératoire et postopératoire. L’accroissement du flux pulmonaire et la compression des voies aériennes par des vaisseaux dilatés et hypertrophiés conduisent à une diminution de la compliance ventilatoire, à une augmentation des résistances aériennes et à une élévation du travail respiratoire. L’importance de ces conséquences va conditionner l’opérabilité et les risques liés à la période postopératoire. Le traitement de l’HTAP repose sur :
Traitement de la crise aigüe :
– ventilation avec FiO2 à 100%
– NO : 10-30 ppm dans le circuit inspiratoire
– Aérosol de prostacycline (iloprost 0.3 mcg/kg)
– Sulfate de magnésium (0.1 mmol/kg)
Traitement chronique :
– Sildénafil (0.3mg/kg/3-6h, max 2-3mg/kg/dose
– Prostaglandine : epoprostenol (3-5ng/kg/mn)
– Anti- endothéline : bosestran (1-2 mg/kg/j per os)
Infection pulmonaire
Le traitement d’une infection pulmonaire par une antibiothérapie adaptée peut être nécessaire avant l’intervention chirurgicale.
Per opératoire
Monitorage standard
Outre l’ECG et la manchette à pression, le monitorage en anesthésie cardiaque comporte quelques éléments particuliers. L’utilisation de l’oxymètre pulsé (SpO2) est de la plus haute importance, car la saturation systémique est le meilleur critère du rapport Qp/Qs lors de shunts cyanogènes ou de restriction au débit pulmonaire. Elle est un signal d’alarme très rapide de l’adéquation de l’oxygénation et de la perfusion périphérique; ses variations suivent fidèlement celles de la PaO2 chez les enfants cyanosés, parce qu’ils sont situés sur la partie verticale de la courbe de dissociation de l’hémoglobine. L’Hb foetale ne modifie pas significativement la lecture.
Le petit enfant doit être équipé de deux capteurs de SpO2, l’un pré-ductal (bras droit) et l’autre post-ductal (pied). Lorsque l’on procède à un banding de l’artère pulmonaire, la SpO2 doit rester supérieure à 85% pour une FiO2 = 0.5. Les nouvelles technologies d’analyse des variations dans l’amplitude de la courbe du saturomètre offrent une possibilité d’évaluer le degré de remplissage et la probabilité de réponse aux perfusions de manière non-invasive. Lors de ligature de canal artériel, la SpO2 aux membres inférieurs permet de détecter une éventuelle ligature de l’aorte descendante, dont les conséquences sont évidemment dramatiques.
La capnométrie (PetCO2) est utilisée de routine. Ses variations sont plus importantes que sa valeur absolue, qui est en général plus basse que celle de la PaCO2. L’écart entre la PaCO2 et la PetCO2 est important chez le petit enfant à cause de l’excès de gaz frais ventilatoire qui dilue l’air expiré et de la localisation du point de captage éloigné du gaz alvéolaire. Il est encore creusé par deux phénomènes [11].
Le shunt D-G, qui est l’équivalent d’un effet espace-mort ;
Le bas débit pulmonaire, en cas d’obstruction droite ou de sténose de l’artère pulmonaire.
Monitorage spécifique
Cathétérisme artériel
La mesure de pression artérielle invasive est nécessaire pour toute opération en CEC et pour les interventions par thoracotomoie, à l’exception de la ligature simple du canal artériel chez le prématuré. Les sites de ponctions préférentielles sont l’artère fémorale et l’artère radiale. Dans les cas de coarctation, d’hypoplasie aortique ou de canal artériel, la pression et la saturation doivent être mesurées en amont (membre supérieur droit) et en aval de la lésion. Dans les corrections d’hypoplasie ou d’interruption de l’arc aortique, il est essentiel de disposer de deux cathéters artériels ; dans les coarctations, une manchette à pression au membre inférieur peut remplacer le cathéter artériel fémoral. Si l’enfant est porteur ou doit subir un shunt périphérique systémique-pulmonaire (Blalock-Taussig), il ne faut pas canuler du côté de l’anastomose. Les suites postopératoires probables influencent aussi le choix du site de ponction: l’artère radiale est plus facile à immobiliser chez un enfant vite réveillé alors que l’artère fémorale n’est adéquate que si l’enfant reste ventilé et immobilisé.
Voie veineuse centrale
La mise en place d’une voie veineuse centrale (2-3 lumières) est le plus souvent nécessaire, que ce soit pour la mesure de la PVC, l’administration rapide et sûre de médicaments en peropératoire, ou l’administration liquidienne postopératoire. De nombreux sites de ponction sont possibles; il faut tenir compte du risque inhérent à chaque technique, des malformations anatomiques et des habitudes de l’anesthésiste. Pour tous les cas, il est recommandé d’utiliser un cathéter à deux ou trois lumières. Les ponctions multiples et le placement de plusieurs voies sur les mêmes axes élèvent significativement le risque de thrombose veineuse cave supérieure si l’hématocrite est élevé.
Cathéters transthoraciques
Les pathologies complexes du petit enfant créent des asymétries profondes entre les différentes cavités cardiaques et une grande labilité hémodynamique postopératoire; cette situation réclame davantage de points de monitorage que chez le grand enfant ou l’adulte. Lorsque la prise en charge postopératoire nécessiterait de connaître la PAP ou la PAPO en continu et que l’anatomie ou la taille de l’enfant ne permettent pas d’introduire un cathéter de Swan-Ganz, il est possible de poser chirurgicalement un cathéter transthoracique dans l’AP et/ou dans l’OG après la CEC. On utilise à cet effet un cathéter central monolumière 20-22G de 10-15 cm. Une bourse autour du site de ponction limite l’hémorragie au retrait du cathéter. Ce type de canulation présente deux dangers:
L’administration accidentelle de substances et/ou d’air directement dans l’OG ; l’étiquetage du cathéter doit être rigoureuse et ne tolérer aucune confusion avec un cathéter veineux central ;
L’ablation du cathéter au 2-3ème jour peut entraîner une tamponnade.
L’échographie transoesophagienne
La miniaturisation des sondes autorise la pratique de l’ETO chez des enfants de petite taille. L’ETO est utile à l’anesthésiste dans cinq circonstances [8, 22, 24]
– Pour évaluer en continu l’hémodynamique et la volémie des enfants souffrant de cardiopathies, parce que les pressions sont des guides peu fiables pour le monitorage hémodynamique dans la complexité anatomique des cardiopathies congénitales ;
– Pour confirmer le diagnostic préopératoire et diagnostiquer d’éventuelles anomalies non découvertes jusque-là (5-8% des cas) ;
– Pour évaluer le résultat des corrections chirurgicales après la CEC (retour en CEC pour complément de correction dans 7% des cas) ;
– Pour aider au placement de canules et cathéters, au choix du site de canulation et au débullage de l’air après CEC ;
– Pour comprendre l’anatomie et la physiologie des cardiopathies et en saisir les implications chirurgicales.
Les recommandations de l’ETO en chirurgie cardiaque pédiatrique sont les suivantes [25,33] :
– Cardiopathies congénitales impliquant une chirurgie de la chambre de chasse droite ou gauche, une plastie valvulaire, une réparation de canal AV ou de CIV ;
– Toute intervention ayant une probabilité élevée de défaut résiduel après correction ;
– Les situations où des mesures quantitatives de flux ou de dimensions modifient la stratégie chirurgicale.
|
Table des matières
PREMIERE PARTIE
1. GENERALITES SUR LES CARDIOPATHIES CONGENITALES
1.1. Particularités du coeur néonatal
1.2. Physiopathologie des shunts
1.3. Physiopathologie de l’hypertension artérielle pulmonaire
1.4. Classification des cardiopathies congénitales
1.4.1. Cardiopathies non-cyanogènes avec shunt G-D
1.4.2. Cardiopathies cyanogènes avec shunt D-G présentant une diminution du flux pulmonaire
1.4.3. Cardiopathies cyanogènes avec shunt D-G présentant une diminution du flux aortique
1.4.4. Cardiopathies cyanogènes avec shunt mixte ou bidirectionnel
1.4.5. Cardiopathies obstructives (non-cyanogènes sans shunt).
2. ANESTHESIE POUR CARDIOPATHIES CONGENITALES
2.1. Pré opératoire
2.1.1. Evaluation clinique
2.1.2. Evaluation paraclinique
2.1.3. Préparation à l’intervention
2.1.3.1. Insuffisance cardiaque
2.1.3.2. HTAP
2.1.3.3. Infection pulmonaire
2.2. Per opératoire
2.2.1. Monitorage standard
2.2.2. Monitorage spécifique
2.2.2.1. Cathétérisme artériel
2.2.2.2. Voie veineuse centrale
2.2.2.3. Cathéters transthoraciques
2.2.2.4. L’échographie transoesophagienne
2.2.3. Induction anesthésique
2.2.3.1. Agents d’anesthésie
2.2.3.2. Technique d’induction anesthésique
2.2.4. CEC chez l’enfant
2.2.5. Sevrage de la CEC
2.3. Post opératoire
2.3.1. Réveil et extubation
2.3.2. Complications post opératoire
DEUXIEME PARTIE
1. Cadre d’étude
2. Patients et méthode
2.1 Type d’étude
2.2 Critères d’inclusion
2.3 Critères d’exclusion
2.4 Méthodologie
2.4.1 Méthode
2.4.2 Recueil des données
2.4.3 Traitement des données
3. Résultats
3.1 Epidémiologie
3.1.1 Nombre
3.1.2 Répartition selon l’âge
3.1.3 Répartition selon le sexe
3.1.4 Répartition selon le poids
3.1.5 Notion de consanguinité
3.1.6 Répartition selon le type de cardiopathie congénitale
3.2 Etude descriptive
3.2.1 Examen clinique
3.2.2 Troubles électrocardiographiques
3.2.3 Bilan biologique préopératoire
3.2.4 Existence de facteurs de risque pour l’intervention
3.2.5 Préparation à l’intervention
3.2.6 Type d’anesthésie
3.2.7 Antibioprophylaxie
3.2.8 Activated clotting time
3.2.9 Circulation Extra corporelle
3.2.10 Durée CEC et clampage Aortique
3.2.11 Complication au cours de la CEC
3.2.12 Utilisation d’amines
3.2.13 . Transfert en réanimation
3.2.14 Complications post CEC
3.2.15 Evolution en réanimation
COMMENTAIRES
CONCLUSION
REFERENCES BIBLIOGRAPHIQUES
Télécharger le rapport complet