La drépanocytose ou Sickle cell disease est une maladie génétique à transmission autosomique récessive, liée à la synthèse d’une hémoglobine anormale : hémoglobine S. La drépanocytose fait partie des maladies les plus répandues dans le monde mais touche essentiellement les populations de l’Afrique intertropicale et constitue l’hémoglobinopathie la plus fréquente en Afrique. Au Sénégal, la prévalence de l’hémoglobine S est de l’ordre de 10 %. La symptomatologie de la maladie est liée à la polymérisation des molécules d’hémoglobine dans les globules rouges responsables de leur fragilisation et ce qui aboutit à une hyperhémolyse et à la perte de leur plasticité. Ces phénomènes sont à l’origine de complications aiguës par vaso-occlusion des microvaisseaux et des complications viscérales chroniques d’origine ischémique pouvant toucher tous les organes. Les complications extrêmement variées dans leur sévérité, leur temporalité, leur localisation, nécessitent dès la naissance une prise en charge multidisciplinaire qui doit intégrer des compétences : médicale, sociale, psychologique, éducationnelle. Une des complications liée à la drépanocytose est l’hémolyse. Cette hémolyse peut être suivie en utilisant plusieurs marqueurs notamment les transaminases ; aussi l’inflammation liée à cette affection peut être appréciée par le dosage des concentrations plasmatiques de la protéine C réactive.
GENERALITES SUR LA DREPANOCYTOSE
Définition
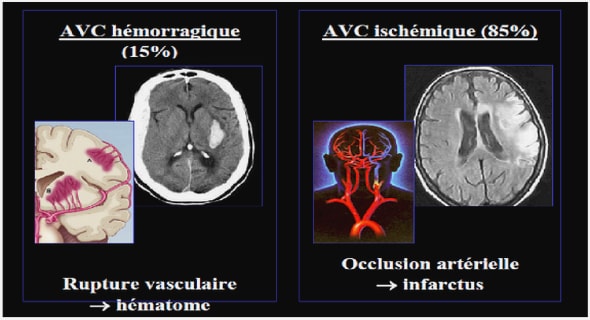
La drépanocytose est une maladie génétique, de transmission autosomique récessive, due à une mutation du sixième codon de la chaîne β-globine de l’hémoglobine (Hb). Les molécules d’hémoglobine drépanocytaire (HbS) ont la propriété, lorsque la saturation en oxygène diminue, de polymériser pour former des fibres intracellulaires qui déforment le globule rouge (GR) et lui donnent sa forme caractéristique en faucille (figure 1). Le drépanocyte perd ses propriétés de plasticité. Il est ainsi plus rapidement détruit qu’un GR normal, ce qui rend compte de l’anémie hémolytique. Cela explique aussi, en partie, la vaso-occlusion caractéristique de cette maladie (3).
Historique
Depuis plusieurs siècles dans la tradition médicale africaine les manifestations cliniques de la drépanocytose ont été identifiées : Hemkom dans la population Adangme signifiant le corps mordu. Nuidudui dans la tribu Ewe signifiant le corps mâché. L’onomatopée « chweechweechwee » chez les Ga reflétant le caractère impitoyable et répétitif de la douleur mais aussi le caractère familial de la maladie (4). En 1910, HERRICK a observé les premières hématies déformées en faucille (sickle– cell) (5). Cette particularité a donné son nom à la maladie : SICKLE CELL DISEASE. En 1917, EMMEL évoque son caractère familial. En 1927, l’explication physiopathologique de la falciformation est donnée par HAHN et GILLEPSIE qui démontrent que la déformation des hématies en faucille n’apparait qu’à basse pression d’oxygène (PO2 inférieur à 45mm/Hg) (5) . En 1933, DIGGS caractérise deux états cliniques différents : celui des malades graves anémiques et celui de leurs parents qui ne présentent aucun symptôme et dont les anomalies cellulaires n’apparaissent qu’in vitro. Ce qui a donné naissance à la notion de « trait drépanocytaire ». En 1947 et en 1949, NEELS et BEET (4) interprétèrent les observations de DIGGS, comme des formes homozygotes et hétérozygotes d’une même anomalie transmise suivant les lois Mendéliennes. En 1949 l’anomalie biochimique est mise en évidence par PAULING, ITANO et SINGER qui isolent l’hémoglobine anormale drépanocytaire (Hb S avec S comme Sickle) sur l’électrophorèse de l’hémoglobine. C’est le premier exemple d’une maladie moléculaire. En 1957, INGRAM met en évidence la lésion moléculaire en découvrant que la substitution de l’acide glutamique par la valine en position 6 sur la chaîne bêta de l’hémoglobine S est à l’origine de la maladie (6). En 1980 YUET WAI KAN met au point le premier test de dépistage génétique de la drépanocytose utilisant pleinement les outils propres au génie génétique moléculaire). En 1990 Frank GROSVELD et ses collaborateurs construisent, sous forme de souris transgéniques, un modèle expérimental de la drépanocytose. Dans les années 60, on montre que c’est sur le chromosome humain 11 que se trouve le gène commandant la production de Hb β. Il y a remplacement sur le codon 6 d’une Adénine par une Thymine : GAG devient GTG. Dès 1949, HALDANE suggéra que la drépanocytose était aussi forte en Afrique. Les patients ayant le trait drépanocytaire HbβS étaient plus résistants au paludisme que les autres. Le Trait drépanocytaire est donc d’une manière évolutionniste, l’expression d’une mutation génique persistante car amenant une meilleure adaptation au paludisme ambiant africain omniprésent et terriblement destructeur pour l’humain… mais une adaptation particulièrement lourde pour celui qui naît Hb SS, homozygote drépanocytaire.
Base moléculaire de la drépanocytose
La drépanocytose est une affection génétique à transmission mendélienne autosomique récessive (7), elle a été l’une des premières maladies dont les mécanismes moléculaires aient été identifiés. Il existe trois variétés d’hémoglobine normales : HbA (ou HbA1), HbA2 qui représentent respectivement 98 % et 2 % de l’hémoglobine totale et HbF (hémoglobine fœtale) qui persistent en faible quantité dans les hématies de l’adulte constituant moins de 1 % de l’hémoglobine totale. La drépanocytose est caractérisée par la présence d’une hémoglobine anormale : hémoglobine S, du mot anglais << sickle>> (faucille). Elle est la plus fréquente et la plus grave des hémoglobinopathies. Elle est due à une mutation ponctuelle par substitution d’un nucléotide au niveau du sixième codon du gène responsable de la synthèse de la globine β, le codon GAG devient GTG. Cette mutation, à l’origine de l’HbS, se distingue sur le plan moléculaire par la substitution de l’acide glutamique par une valine, en position 6 sur la chaîne β. Sous forme désoxygéné, l’HbS se polymérise en fibre infra érythrocytaire qui déforme le globule rouge en faucille ou en croissant : c’est le drépanocyte .
Épidémiologie
Selon les projections de l’OMS (Organisation Mondiale de la Santé), le nombre de porteurs de l’anomalie de l’hémoglobine se situe à 8% de la population mondiale. Les chiffres de 1994 faisaient état de 2,9 % soit 150 millions de la population mondiale porteuse d’une mutation thalassémique et de 2,3 % soit 120 millions de personnes porteuses d’une mutation drépanocytaire (9). La grande fréquence de ces deux types de mutation s’explique par la projection relative qu’elles apportent contre le paludisme à l’état hétérozygote. Dans les pays industrialisés la répartition dépend du flux migratoire et également des progrès de la médecine. Au Sénégal, la prévalence de l’hémoglobine S est de l’ordre de 10 % de la population sans distinction d’origine géographique, de classe sociale, d’ethnie ou de religion, soulignant que 1700 enfants malades de drépanocytose naissent chaque année au Sénégal des unions qui se scellent entre porteurs du trait drépanocytaire. Dans un grand nombre de pays africains tropicaux, la drépanocytose constitue un problème majeur de santé publique qui touche 2 % de tous les nouveau-nés, ainsi plus de 200000 enfants naissent atteints de drépanocytose chaque année en Afrique. Dans certaines zones rurales d’Afrique, le taux d’enfants atteints de drépanocytose qui ne décèdent pas avant l’âge de 5 ans avoisine 98 %. On estime que la maladie est directement ou indirectement responsable de 8 à 10 % des cas de mortalité infantile dans la plupart des pays d’Afrique tropicale. Néanmoins, peu de pays africains ont mis sur pied des programmes de lutte contre la drépanocytose. En outre, le continent a un nombre restreint de spécialistes formés à la prise en charge moderne de la maladie. Au moment où l’on enregistre des progrès en matière de diagnostic et de traitement dans le monde développé, l’Afrique ne compte qu’une poignée de centres de lutte contre la drépanocytose. La plupart des enfants atteints de drépanocytose en Afrique, meurent avant même d’avoir pu bénéficier d’un diagnostic approprié et la majorité des patients n’ont jamais eu la chance de rencontrer un spécialiste (10).
Couleur rouge: zone avec forte concentration de personnes drépanocytaires Couleur rose : zone avec moins forte concentration de personnes drépanocytaires.
Physiopathologie
La physiopathologie est très complexe et fait intervenir de multiples facteurs : génétique, tissulaire et vasculaire.
La polymérisation de l’hémoglobine S
Le remplacement d’un acide glutamique par une valine en position 6 à la surface de la molécule de la chaîne β de la globine provoque une série de modifications structurales qui aboutissent à une diminution de la solubilité et la polymérisation de sa forme déoxygénée de l’hémoglobine drépanocytaire. La polymérisation s’observe in vitro dans des solutions d’hémoglobine concentrées, ainsi qu’in vivo dans le globule rouge. Cette polymérisation aboutit à la formation d’un gel. Il a été montré in vitro que la formation du gel par les molécules de déoxyhémoglobine S n’était pas un phénomène instantané, mais qu’elle était précédée d’une période de latence (12) d’une durée variable allant de la milliseconde à plusieurs minutes. Des facteurs physicochimiques favorisent la polymérisation et la formation de gel : augmentation concentration ionique, augmentation température, abaissement du pH, du taux en acide 2,3- diphosphoglycérique (2,3-DPG), l’hypoxie ou la déshydratation cellulaire. Sous l’effet de la désoxygénation, les molécules d’hémoglobine S s’agrègent en longs polymères ou tactoïdes (figure 6). In vivo, cette modification structurale de la désoxy-HbS provoque à l’intérieur du globule rouge le passage de l’état fluide à l’état para-cristallin.
La concentration en hémoglobine est un facteur essentiel qui influence la polymérisation des molécules de déoxyhémoglobine S. C’est la raison pour laquelle les associations α-thalassémie et drépanocytose réduisent la polymérisation en diminuant la concentration en hémoglobine intraérythrocytaire.
Au niveau érythrocytaire
Dans le globule rouge, l’hémoglobine est à une concentration voisine de 33 g/dl, ce qui correspond à la concentration corpusculaire moyenne en hémoglobine (CCMH). La polymérisation des molécules d’hémoglobine S dans leur configuration déoxygéné provoque la formation intracellulaire de longues fibres allongées. La formation de ces fibres entraîne une modification de forme du globule rouge qui acquiert un aspect en faux : le drépanocyte. Les cellules falciformées sont hétérogènes, tant en ce qui concerne leur aspect morphologique que leur densité. Le pourcentage des cellules denses (d > 1,120) est faible, voire nul chez le sujet normal; il est plus ou moins élevé chez le sujet drépanocytaire. Les drépanocytes font partie des cellules les plus denses dont la concentration en hémoglobine peut être supérieure à 40 g/dl. II est bien évalué par les courbes de densité érythrocytaire, par ektacytometrie et par l’indice de distribution des hématies fourni par les automates de cytologie hématologique. La déshydratation du globule rouge drépanocytaire est régulée par :
– Une perte nette de K+, de Cl- et d’eau ; l’activité de ce système est environ 10 fois plus élevée dans les globules rouges drépanocytaires que dans les globules rouges normaux, plus importante dans les fractions les plus légères correspondant aux réticulocytes et aux érythrocytes jeunes ;
– le canal K+ active par le calcium (canal Gardos). Enfin, une augmentation de l’adhésion des réticulocytes drépanocytaires à l’endothélium vasculaire a aussi été mise en évidence (13). Celle-ci ralentirait le flux sanguin et favoriserait la falciformation des globules rouges. Des liaisons moléculaires complexes existent entre :
– l’intégrine α4 β1, récepteur de la fibronectine sur les réticulocytes et le VCAM 1 (vascular cell lesion molecule) sur la cellule endothéliale ;
– le récepteur CD36 qui lie la thrombospondine et le collagène, présent à la surface des cellules endothéliales, des plaquettes et de la sous-population enrichie en réticulocytes ;
– les glycolipides sulfates qui lient la thrombospondine et les multimètres du facteur Von Willebrand (vWF) qui stimulent l’adhésion des globules rouges drépanocytaires. Le phénomène de falciformation est réversible pendant plusieurs cycles jusqu’à la fixation définitive de la cellule sous la forme d’un drépanocyte irréversible.
|
Table des matières
INTRODUCTION
PREMIERE PARTIE : REVUE BIBLIOGRAPHIQUE
I. GENERALITES SUR LA DREPANOCYTOSE
1. Définition
2. Historique
3. Base moléculaire de la drépanocytose
4. Épidémiologie
5. Physiopathologie
6. Symptomatologie de la drépanocytose
6.1. Les syndromes drépanocytaires majeurs
6.2. La drépanocytose homozygote
7. Méthodes de diagnostic
8. Traitement
DEUXIEME PARTIE
I. METHODOLOGIE
1. Cadre et type d’étude
2. Population d’étude
3. Paramètres étudiés
4. Prélèvements
5. Méthodes de dosage
5.1. Transaminases
5.2. CRP
5.3. La numération formule sanguine
5.4. Exploitation statistique
II. RESULTATS
1. Caractéristiques générales de la population
2. Répartition de la population suivant le sexe
3. Répartition de la population d’étude suivant le profil clinique
4. Évaluation de la CRP et de l’activité des transaminases dans notre population d’étude
4.1. Transaminases
4.2. CRP
5. Evaluation de la CRP et des transaminases selon le tableau clinique
III. DISCUSSION
CONCLUSION
REFERENCES